4 ingredienti potenti per aiutarti a dormire bene
Una delle chiavi per una vita sana è dormire bene la notte. È durante il sonno che il nostro corpo svolge le sue principali funzioni ricostituenti, come la riparazione dei tessuti, la crescita muscolare e la sintesi proteica. In questo periodo è possibile reintegrare le energie e regolare il metabolismo, fattori essenziali per mantenere un corpo e una mente sani e prevenire l’insorgere di malattie croniche. Il sonno è importante anche per la regolazione dell’appetito, poiché regola gli ormoni legati allo stress (cortisolo), aiutando a controllare il peso e i livelli di glucosio nel sangue.
Quante ore al giorno dovremmo dormire?
Le esigenze di sonno variano da persona a persona, tuttavia, sono definite le medie di età (Tabella 1). Ad esempio, per gli adulti, gli esperti raccomandano una media di 7-8 ore di sonno al giorno a orari regolari e ininterrotti.
Tabella 1: Ore di sonno consigliate in base all’età (1)
| Valori medi per: | ore di sonno/giorno |
| Neonati | 14-17 |
| Prima infanzia | 12-16 |
| Bambini (1-2 anni) | 11-14 |
| Bambini in età prescolare (3-5 anni) | 10-13 |
| Bambini in età scolare (6-12 anni) | 9-12 |
| Adolescenti | 8-10 |
| Adulti | 7-9 |
| Anziani (65+ anni) | 7-8 |
Sfortunatamente, in vari momenti della nostra vita, ottenere questa quantità di sonno e con la qualità necessaria è quasi impossibile e particolarmente deprimente quando si soffre di insonnia. Lo stress e le preoccupazioni quotidiane possono influenzare negativamente i ritmi biologici, rendendo il sonno più difficile e diminuendo la sua qualità.
Le benzodiazepine
Una risorsa ampiamente utilizzata per il trattamento dei disturbi gravi del sonno e dell’ansia sono i farmaci psicoattivi a base di benzodiazepine, come diazepam (Valium), alprazolan (Xanax), lorazepam (Ativan), estazolam (Prosom) e altri. Questi farmaci devono essere usati razionalmente e sotto stretta prescrizione medica, poiché generano molto facilmente dipendenza. Infatti, l’uso di benzodiazepine per un periodo di tempo che va dalle 3 alle 6 settimane circa, anche a dosi terapeutiche, porta facilmente ad uno stato di dipendenza (2).
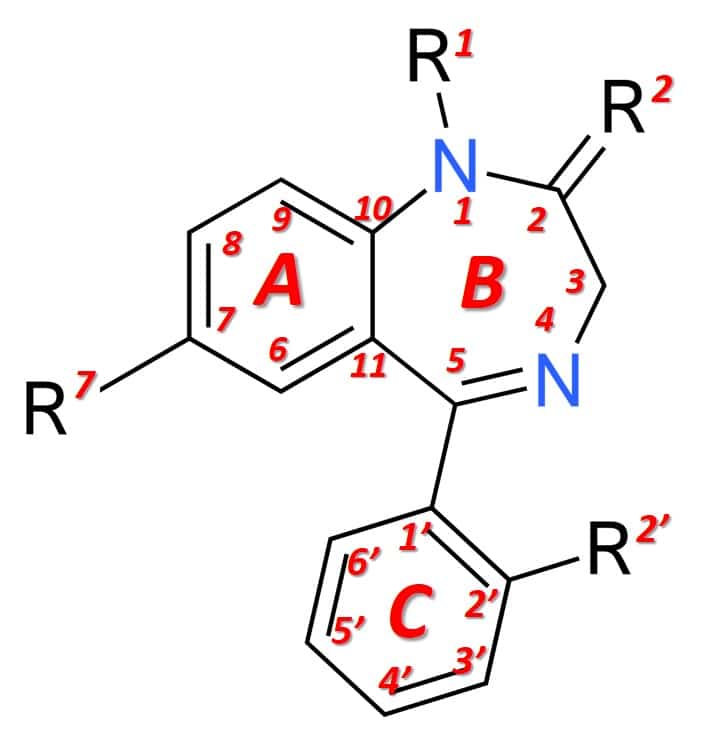
Strutturalmente (figura 1), le benzodiazepine sono il risultato della fusione di un anello benzenico (anello A) con un anello 1,4-diazepinico (anello B). Le benzodiazepine che esprimono effetti anestetici più marcati hanno, inoltre, un anello arilico in posizione 5 (C-ring), che ne aumenta la potenza a livello farmacologico. Le diverse benzodiazepine disponibili sul mercato hanno diversi gruppi chimici nelle posizioni 1, 2, 5 o 7 e inoltre in 2′, che modulano le proprietà farmacologiche, la potenza dell’effetto e le condizioni farmacocinetiche (durata dell’effetto, distribuzione, ecc. .).
Figura 1: Struttura generale delle benzodiazepine.
Il meccanismo d’azione delle benzodiazepine
L’acido γ-aminobutirrico (GABA) è il più importante neurotrasmettitore inibitorio del sistema nervoso centrale. La funzione del GABA è quella di inibire o ridurre l’attività neuronale attraverso la sua azione su specifici recettori chiamati recettori GABA-A. Questi recettori sono proteine situate sulle membrane dei neuroni negli spazi sinaptici (lo spazio tra un neurone presinaptico e uno postsinaptico), dove avviene la sinapsi chimica. Di conseguenza, l’inibizione dell’attività neuronale produce un senso di calma, rilassamento muscolare e sedazione, che svolge un ruolo importante nel comportamento, nella cognizione e nella risposta del corpo allo stress (3). A causa della loro capacità di legarsi a determinati siti (subunità alfa) situati sui recettori GABA-A, le benzodiazepine modulano l’effetto del GABA agendo come potenziatori del suo effetto soppressivo sull’attività neuronale. Per questo motivo, le benzodiazepine sono responsabili di provocare effetti ansiolitici (riducenti l’ansia), ipnotici (induttori del sonno), sedativi, anticonvulsivanti e miorilassanti.
Il problema di salute pubblica generato dal consumo di benzodiazepine
Il problema principale associato al consumo di benzodiazepine è la loro capacità di generare dipendenza. Uno dei segni tipici dell’instaurarsi di dipendenza in molti pazienti è l’insorgere della sindrome da astinenza, causata da una brusca interruzione dell’assunzione cronica e prolungata di queste sostanze. I sintomi tipici della sindrome da astinenza sono: ansia, attacchi di panico, iperventilazione, tremori, disturbi del sonno, spasmi muscolari, anoressia, calo ponderale, disturbi visivi, sudorazione, disforia, ipersensibilità al rumore, convulsioni, allucinazioni e deliri. A complicare ulteriormente la situazione, in molti paesi europei (4,5), le benzodiazepine sono frequentemente utilizzate in modo incontrollato dalla popolazione, dando luogo a un grave problema di salute pubblica che preoccupa le autorità, in quanto la dipendenza da questa sostanza è di difficile gestione terapeutica.
Le sensazioni piacevoli che normalmente generano le droghe che creano dipendenza, che sono disastrosamente attraenti per gli individui vulnerabili, si verificano quando i livelli di dopamina nell’area della ricompensa (o del piacere) del cervello aumentano bruscamente. Questi tipi di farmaci interferiscono con i meccanismi naturali del corpo di controllare il flusso di dopamina. Più specificamente, le benzodiazepine indeboliscono l’azione di un gruppo di neuroni chiamati interneuroni, che si trovano nell’area tegmentale ventrale del cervello (VTA). Questi interneuroni normalmente aiutano a prevenire livelli eccessivi di dopamina regolando i tassi di scarica dei neuroni produttori di dopamina. Pertanto, quando le benzodiazepine limitano l’influenza restrittiva degli interneuroni, i neuroni che producono dopamina rilasciano più dopamina del normale. (6)
La dopamina è la sostanza chimica che media il piacere nel cervello. La sua produzione avviene in situazioni piacevoli e mira a stimolare il perseguimento di attività piacevoli, importanti per la sopravvivenza, come il cibo o il sesso. Alcuni farmaci come gli oppioidi e le benzodiazepine hanno la capacità di stimolare artificialmente la produzione di dopamina nel cervello, dando luogo a squilibri nel naturale processo di ricompensa/sopravvivenza.
Alternative naturali alle benzodiazepine
Poiché i fattori responsabili dell’ansia e dell’insonnia non dovrebbero diminuire, è essenziale per la qualità della vita del paziente trovare alternative ansiolitiche con un potenziale minore per indurre reazioni avverse. In questo senso c’è stato un grande interesse da parte della comunità scientifica per lo studio delle piante medicinali (7). Fin dall’antichità alcune piante sono state utilizzate per la cura dell’insonnia e dell’ansia e, attualmente, l’uso dei loro estratti ha riscosso un crescente consenso da parte della professione medica (7).
Tuttavia, la maggior parte delle piante medicinali è priva di dati chimici e farmacologici e, in molti casi, i loro principi attivi non sono stati ancora identificati e studiati chimicamente. Si prevede che con il progresso degli studi scientifici nel campo della fitochimica e della fitomedicina, avremo un numero maggiore di risorse naturali per aiutare nel trattamento di questo tipo di disturbo.
Tra le varie piante medicinali note per le loro proprietà ansiolitiche, sedative e miorilassanti, possiamo evidenziare kava-kava (Piper methysticum), passiflora (Passiflora incarnata), grifone (Griffonia simpliciflia), valeriana (Valeriana officinalis), camomilla (Matricaria recutita ) e arnica (Galphimia glauca). Queste piante sono state ampiamente studiate e sono stati identificati i loro principi attivi più importanti. Tra gli esempi citati, il kava-kava non era più autorizzato come ingrediente negli integratori alimentari in Europa dal 2002 a causa di sospetta epatotossicità (8).
L’esempio di 4Sleep: 4 potenti ingredienti per aiutarti a dormire meglio
Consapevole della necessità di offrire alternative sicure per aiutare le persone che soffrono di insonnia e hanno difficoltà ad addormentarsi, Nutribiolite ha sviluppato 4Sleep. È un integratore alimentare over-the-counter, che combina melatonina ed estratti concentrati di griffonia, valeriana e camomilla. Ciascuno di questi ingredienti ha dimostrato singolarmente, in diversi articoli scientifici pubblicati su riviste specializzate, importanti proprietà ansiolitiche che aiutano a favorire i processi biologici associati al rilassamento e alla conciliazione del sonno. La combinazione di questi ingredienti mira ad ottenere un effetto additivo che fornisce un effetto progressivo e duraturo. Nei capitoli seguenti, forniamo un breve riassunto delle proprietà di ciascuno di questi ingredienti di 4Sleep.
Melatonina
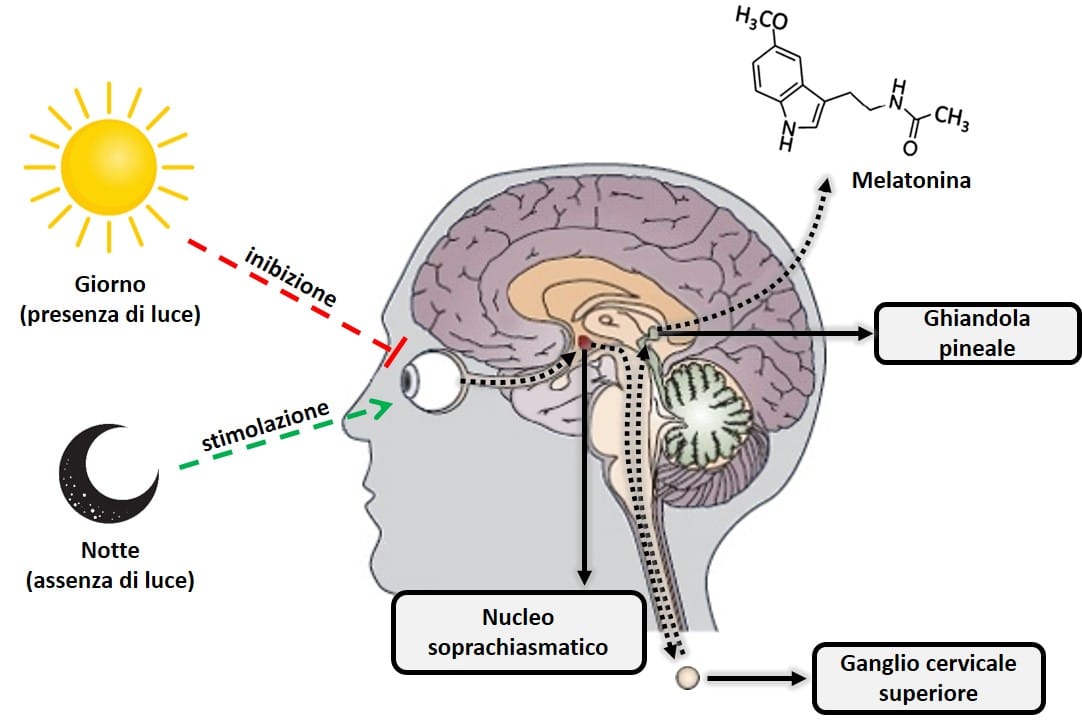
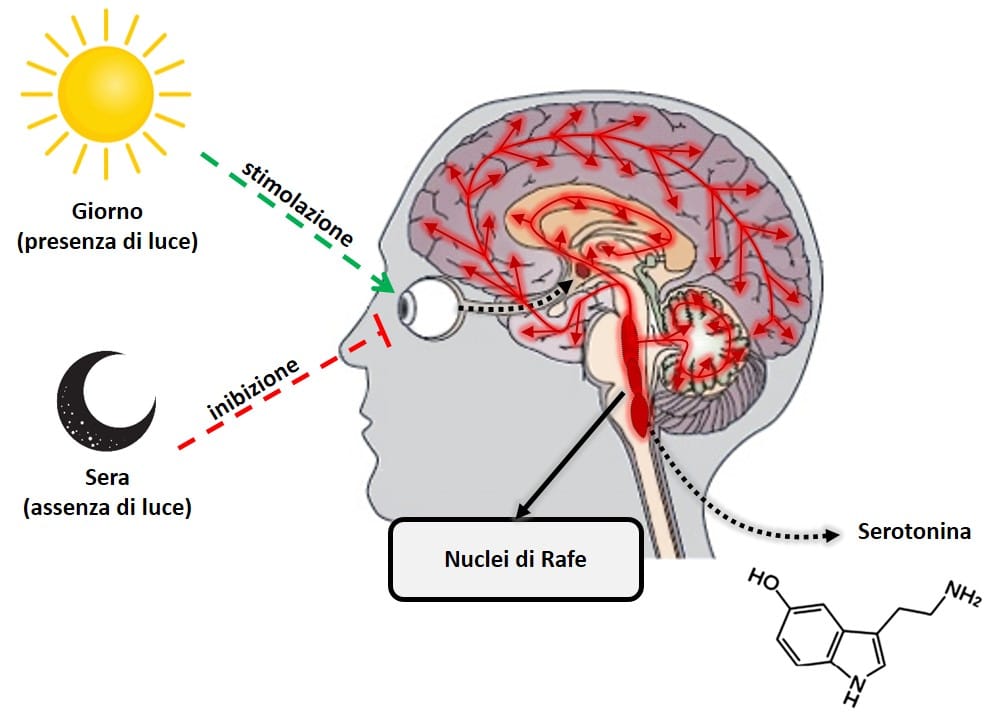
La melatonina, o N-acetil-5-metossitriptamina, è un ormone prodotto principalmente dalla ghiandola pineale (situata nella parte posteriore del cervello) dall’aminoacido triptofano e derivato da un altro ormone, la serotonina. La melatonina è estremamente importante nella regolazione dell’orologio biologico del corpo (ciclo circadiano o ciclo sonno-veglia) e del metabolismo energetico. Questo ormone viene prodotto quando la retina rileva l’assenza di luce, in modo tale che la sua biosintesi quotidiana obbedisca precisamente a una produzione ritmica circadiana sincronizzata con il ciclo di illuminazione ambientale caratteristico del giorno e della notte. Questa produzione ritmica giornaliera è tale che, in qualsiasi specie considerata, il picco di produzione si verifica durante la notte. Un’altra importante caratteristica del sistema neurale funzionale che regola la sintesi della melatonina è che la luce presente nell’ambiente di notte può bloccare completamente (a seconda della sua intensità e lunghezza d’onda, principalmente luce blu 480 nm), la sintesi della melatonina pineale (9). Per questo motivo la totale assenza di luce artificiale è importante per conciliare il sonno. Abitudini come l’utilizzo di uno smartphone o altro dispositivo elettronico con schermi luminescenti rendono difficile creare i meccanismi biologici che innescano la produzione naturale di melatonina.
Clicca sull’immagine per ingrandirla
Figura 2: Schema di processi che inibiscono e stimolano la produzione pineale di melatonina.
La quantità di melatonina non è costante per tutta la vita. La sua produzione inizia nei neonati dopo i 3-4 mesi di età e i suoi livelli aumentano durante l’infanzia fino a raggiungere un valore massimo tra gli 8-10 anni. Da lì, la loro produzione inizia a declinare, un processo che avverrà fino alla fine della loro vita. Quando raggiungiamo i 40-45 anni di età, si verifica un’improvvisa diminuzione della produzione di melatonina. Negli individui di età superiore ai 70 anni, i livelli di melatonina sono già inferiori al 10% dei valori tipicamente osservati nei bambini di età compresa tra 8-10 anni (10).
Secondo diversi studi scientifici, l’integrazione orale con melatonina è benefica e aiuta a ridurre il tempo necessario per addormentarsi (11, 12), aiuta a ridurre i disturbi del sonno legati al jet lag nei lavoratori notturni (13), nei disturbi da deficit di attenzione e iperattività (ADHD) (14), alterazioni del ritmo circadiano nelle persone cieche (15) e problemi del sonno derivanti dalla menopausa (16, 17). La melatonina attraversa facilmente la barriera ematoencefalica, accumulandosi nel sistema nervoso centrale a livelli sostanzialmente superiori a quelli riscontrati nel sangue (18). In questo senso, l’integrazione di melatonina (esogena) è abbastanza efficiente, specialmente in individui con bassi livelli di melatonina endogena (19). A causa del facile accumulo di melatonina nel cervello, non è consigliabile assumere elevate quantità giornaliere di questa sostanza, soprattutto negli individui più anziani, a causa della ridotta funzionalità epatica e renale, nonché dei cambiamenti nella composizione corporea (ritenzione di grasso e acqua) che alterano le proprietà farmacocinetiche della melatonina e aumentano il rischio di effetti avversi come la sonnolenza del giorno dopo (20, 21).
Tenendo conto della ricerca di un miglior rapporto rischio/beneficio per i consumatori europei, nel 2001, a seguito di una richiesta della Commissione europea, il gruppo di esperti scientifici sui prodotti dietetici, l’alimentazione e le allergie dell’Autorità europea per la sicurezza alimentare (EFSA) ha pubblicato un parere scientifico sui benefici proprietà della melatonina per il sonno e su quali quantità sarebbero ideali per ottenere questi benefici. Il panel ha preso in considerazione diversi studi di meta-analisi controllati con placebo in persone senza problemi di sonno, in individui con disturbi del sonno primari e in individui con insonnia (26). Secondo questa revisione scientifica, l’EFSA ha concluso che la quantità di 1 mg di melatonina consumata prima di andare a letto aiuta efficacemente a conciliare il sonno (22–25). Di conseguenza, diversi paesi europei hanno fissato limiti alla dose massima giornaliera autorizzata di melatonina negli integratori alimentari, ad esempio: Spagna (1,9 mg), Portogallo (1,9 mg), Grecia (3,0 mg), Francia (2,0 mg) , Paesi Bassi (0,3 mg) e Italia (1 mg). Da questi valori la melatonina è considerata un farmaco e la sua vendita è controllata da prescrizione medica e indicata solo per le persone clinicamente diagnosticate con un deficit di melatonina endogena.
Sulla base della consulenza scientifica dell’EFSA e nel rispetto delle normative di tutti i paesi europei in cui Nutribiolite commercializza i suoi prodotti, 4Sleep incorpora esattamente 1 mg di melatonina nella sua formula. Infatti, secondo diversi studi di meta-analisi (22–25), una quantità maggiore (fino a 1,9 mg) di questo principio attivo non è necessaria. Inoltre, il processo di conciliazione del sonno dipende anche da altri meccanismi di rilassamento innescati nel sistema nervoso centrale, e per questo motivo 4Sleep si basa sulla combinazione della melatonina con altri tre principi attivi ottenuti dalle piante medicinali grifone, valeriana e camomilla che descriviamo in seguito.
Griffonia: fonte di 5-HTP e precursore di serotonina e melatonina
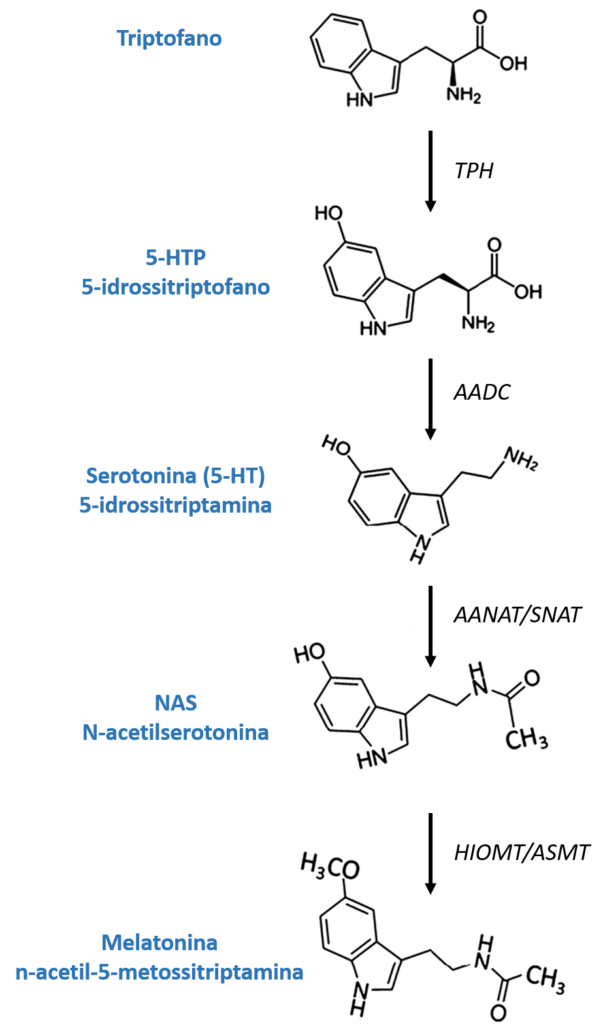
Un altro principio attivo presente nella formula 4Sleep è l’L-5-idrossitriptofano, noto anche come 5-HTP, precursore e amminoacido intermedio nella biosintesi dei neurotrasmettitori serotonina e melatonina (figura 3). L’esistenza del 5-HTP in natura non è limitata solo ai mammiferi, come gli esseri umani, ma è anche prodotta da piante, funghi e microbi. Il seme di griffonia (Griffonia simplicifolia (DC.) Baill.) è una delle fonti vegetali più ricche di 5-HTP, che ha portato allo sviluppo di metodi molto robusti sia per la produzione di estratti concentrati che per la loro caratterizzazione analitica. Di conseguenza, sia i laboratori farmaceutici che i laboratori di produzione di integratori alimentari hanno attualmente a disposizione estratti di grifone standardizzati in termini di 5-HTP di eccellente qualità (27). 4Sleep utilizza un estratto di gryphony altamente concentrato in 5-HTP (> 20%), determinato mediante cromatografia liquida ad alte prestazioni (HPLC).
Clicca sull’immagine per ingrandirla
Figura 3: Biosintesi della melatonina
La conversione del 5-HTP in serotonina nel corpo avviene attraverso l’enzima AADC (L-aminoacido decarbossilasi aromatico). La sua conversione in melatonina coinvolge due enzimi prodotti dalla ghiandola pineale dopo essere stati indotti dalla retina per mancanza di luce: l’enzima SNAT (serotonina-N-acetiltransferasi) converte la serotonina in N-acetilserotonina e l’enzima (HIOMT) idrossiindolo- L’O-metiltransferasi trasferisce un gruppo metilico dalla S-adenosilmetionina al 5-idrossile della N-acetilserotonina, dando origine alla melatonina.
La serotonina e la melatonina sono quasi letteralmente giorno e notte in termini ormonali. Questi due ormoni svolgono un lavoro opposto, ma in completa armonia, per mantenere il corpo in equilibrio. La serotonina, nota come “ormone della felicità”, è un neurotrasmettitore che svolge un ruolo chiave nella regolazione di quasi tutte le funzioni del sistema nervoso centrale, come umore, ansia, stress, fame, cognizione e comportamento sessuale. A differenza della melatonina, la serotonina ha il suo picco di produzione durante il giorno, quando la retina rileva la presenza di luce. La sua produzione avviene principalmente in un’area del cervello chiamata nuclei del rafe.
Clicca sull’immagine per ingrandirla
Figura 4: Produzione di serotonina da nuclei di rafe
La funzione del 5-HTP in 4Sleep è quella di fornire una fonte secondaria di melatonina, che sarà prodotta gradualmente attraverso la serotonina durante la notte. Infatti, diversi studi scientifici hanno riscontrato che la somministrazione di 5-HTP, oltre ad aumentare i livelli di serotonina, produceva anche un aumento dei livelli di melatonina (28).
Nonostante agisca come una fonte di 5-HTP nel corpo, l’integrazione con L-triptofano invece di 5-HTP, al fine di aumentare i livelli di serotonina e melatonina nel corpo, presenta degli svantaggi. Questo perché il corpo utilizza L-triptofano anche per altri scopi, come la formazione di proteine e la produzione di niacina dalla chinurenina. Inoltre, il 5-HTP attraversa molto più facilmente la barriera ematoencefalica, convertendosi in serotonina più rapidamente (ha una maggiore biodisponibilità) (29)
Camomilla
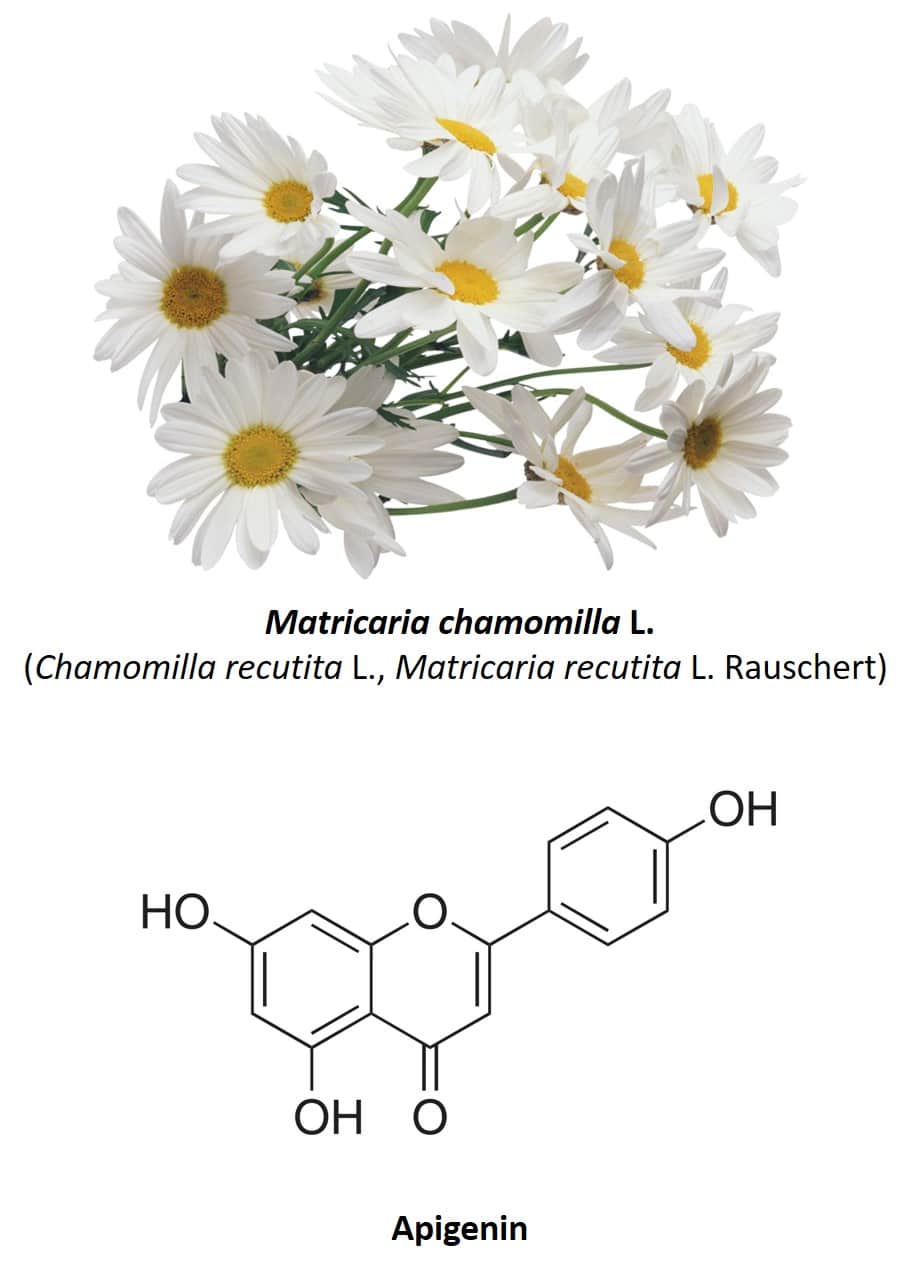
Una caratteristica delle piante medicinali è il fatto che sono quasi sempre costituite da una variegata miscela di principi attivi, il che fa sì che le stesse specie vegetali presentino diverse proprietà medicinali. La camomilla o Matricaria chamomilla L. (nota anche come Chamomilla recutita o Matricaria recutita) (figura 5) ne è un chiaro esempio. Questa pianta erbacea originaria dell’Europa e dell’Asia occidentale ha diversi usi medicinali, incluso il suo uso come antinfiammatorio, antibatterico, digestivo, ansiolitico, antispasmodico e anticonvulsivante (30, 31). La parte più utilizzata della pianta sono i suoi fiori, costituiti da diversi composti fenolici, principalmente i flavonoidi apigenina, quercetina, patuletina, luteolina e suoi glicosidi (31). Per quanto riguarda le proprietà ansiolitiche della camomilla, queste sono dovute alla presenza dell’apigenina, un polifenolo flavonoide molto abbondante nei fiori di questa pianta e che costituisce il 68% del suo contenuto totale di flavonoidi (32).
Figura 5: Camomilla e struttura chimica dell’apigenina.
Le proprietà ansiolitiche della camomilla sono state studiate per la prima volta nel 1982 dal gruppo del Dott. Roberto DellaLoggia della Facoltà di Farmacia dell’Università di Trieste (33). Utilizzando un modello animale con ratti, è stato osservato che la somministrazione di un infuso di camomilla era in grado di esercitare un’azione depressiva sul sistema nervoso centrale degli animali, riducendo il ritmo basale e inducendo il sonno. È stato inoltre osservato che l’intensità di questi effetti dipendeva dalla concentrazione dell’infusione utilizzata, il che confermava anche che gli effetti ansiolitici osservati provenivano dalla somministrazione di camomilla. Dopo questo studio ne sono seguiti molti altri, ma ora con l’obiettivo di individuare la componente vegetale responsabile di questa proprietà. Nel 1995 Viola e collaboratori hanno dimostrato che il fiore di camomilla contiene diverse molecole in grado di legarsi in modo competitivo agli stessi siti di legame delle benzodiazepine, tra le quali spiccava l’apigenina, che nel ratto presenta una spiccata attività ansiolitica (34). In altre parole, questo studio ha suggerito che l’apigenina potrebbe avere proprietà simili alle benzodiazepine, legandosi agli stessi siti di legame utilizzati dalle benzodiazepine nei recettori GABA-A. Altri studi suggeriscono che gli effetti dell’apigenina sui recettori GABA-A sono più complessi e che altri recettori possono essere coinvolti nei suoi effetti ansiolitici (35–37). L’apigenina molto probabilmente agisce come modulatore di secondo ordine dei recettori GABA-A, in questo caso aumentando l’effetto di un modulatore di primo ordine. Le attività sedative e ansiolitiche dell’apigenina osservate nei ratti (34,35) possono essere interpretate sulla base dell’apigenina, potenziando l’azione di agenti endogeni simili alle benzodiazepine nei neuroni (38, 39).
A causa delle proprietà medicinali benefiche dei fiori di camomilla, l’Autorità europea per la sicurezza alimentare (EFSA) sta attualmente valutando diverse dichiarazioni sulla salute relative alla camomilla come contributo al rilassamento (EFSA-Q-2010-00538) e al mantenimento di un sonno sano (EFSA-Q-2010-00586).
In 4Sleep, ogni capsula (che corrisponde alla dose giornaliera consigliata), contiene 110 mg di un estratto concentrato (4:1) di camomilla, che equivale al consumo di 440 mg di fiori di camomilla essiccati per porzione. Questo è un modo comodo ed efficace per ottenere i benefici della camomilla.
Valeriana
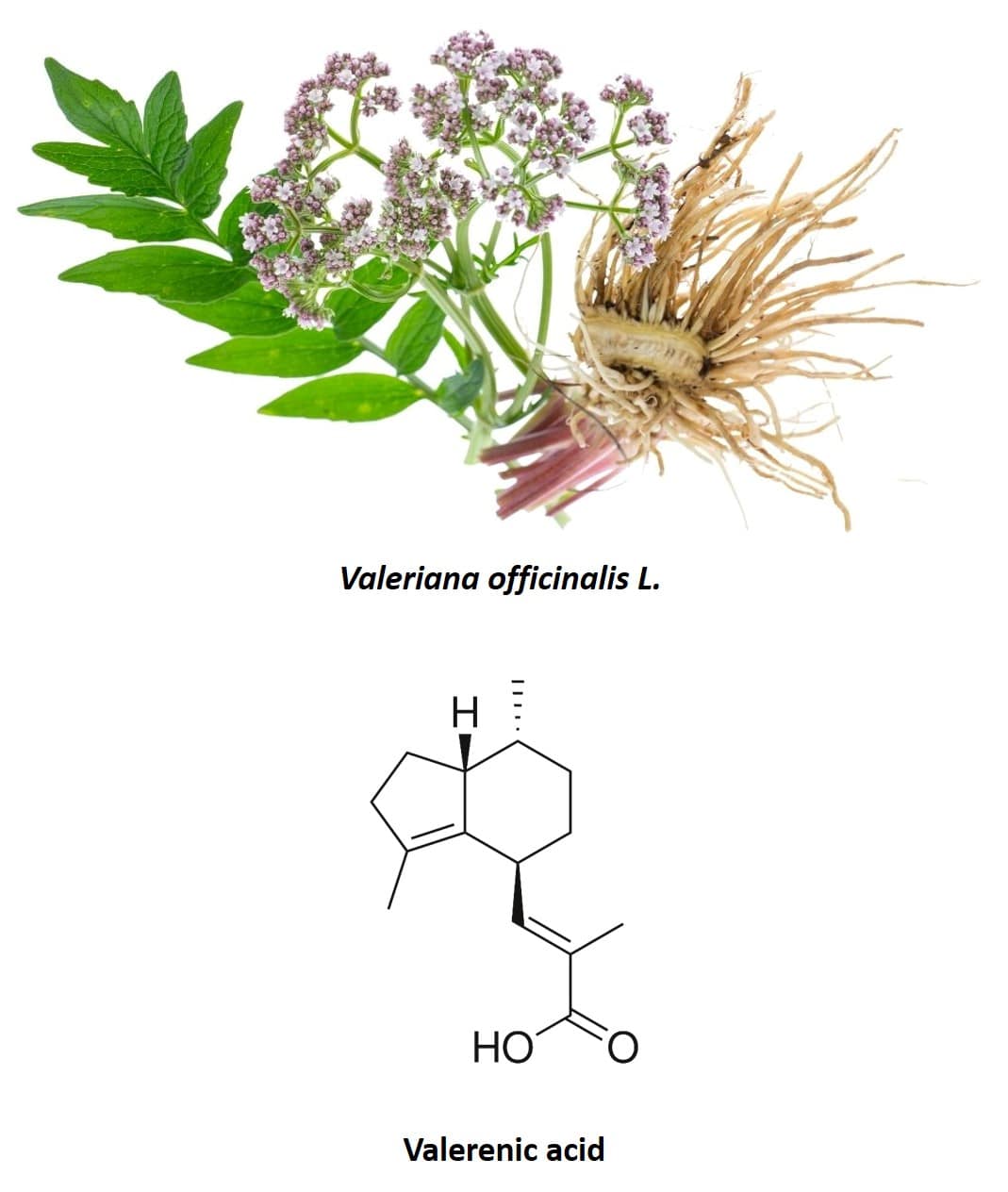
Anche la valeriana (Valeriana officinalis L.), pianta perenne originaria del Nord America, dell’Asia e dell’Europa, è un’altra specie tradizionalmente utilizzata per le sue proprietà ansiolitiche (40) (figura 6). È infatti una delle specie più utilizzate e una delle quali sono stati condotti più studi per verificarne gli effetti nel trattamento dell’insonnia e di altri sintomi associati al nervosismo. La parte più utilizzata della pianta è la sua radice, costituita da diversi sesquiterpenoidi e iridoidi. I composti attivi più importanti nella radice di valeriana sono i valepotriati (un iridoide) e l’acido valerenico (un sesquiterpenoide). In origine si pensava che solo i valepotriati fossero responsabili degli effetti sedativi della valeriana, tuttavia è stato dimostrato che anche estratti puramente acquosi di valeriana, come quelli ottenuti in infusi (tè), hanno un effetto sedativo (40, 41). Poiché i valepotriati non sono solubili in acqua, si è concluso che l’acido valerenico presente nella radice di valeriana aveva anche proprietà ansiolitiche ed era il principale componente chimico responsabile dell’effetto osservato negli studi clinici sull’uomo. Oltre ai valepotriati e all’acido valerenico, nel 2002 è stato isolato per la prima volta il flavonoide 6-metilapigenina e questa molecola ha dimostrato di essere in grado di legarsi ai recettori GABA-A, producendo un effetto ansiolitico simile alle benzodiazepine (42). Negli anni successivi furono isolati i glicosidi esperidina (43) e linarina (44), anch’essi in grado di legarsi ai recettori GABA-A, presentando proprietà sedative e ipnotiche. Inoltre, l’effetto dell’esperidina è stato sinergicamente potenziato dalla 6-metilapigenina e quello della linarina dall’acido valerenico presente nella composizione della valeriana.
Figura 6: Radice di valeriana e struttura chimica dell’acido valerenico.
I valepotriati hanno mostrato citotossicità negli studi in vitro, sebbene ciò non sia stato dimostrato negli studi in vivo. A causa dell’elevata instabilità chimica dei valepotriati, sono difficilmente presenti in preparati fitofarmaci commerciali come gli integratori alimentari e, inoltre, hanno un basso assorbimento (45). In ogni caso, gli estratti di valeriana utilizzati negli integratori alimentari sono ottenuti attraverso una miscela controllata di acqua/bioetanolo in modo da non estrarre valepotriati.
4Sleep Valerian Extract è certificato da laboratori accreditati e non contiene valepotriati. Il requisito per questo certificato è uno dei criteri necessari per la sua commercializzazione in Europa.
Di tutti i componenti della valeriana, quello che esercita l’effetto ansiolitico più importante è l’acido valerenico (46). Inoltre, tra tutte le sostanze identificate nella valeriana che detengono questa proprietà, l’acido valerenico è quella che è presente in maggior quantità in questa pianta. Questa sostanza ha anche la capacità di modulare i recettori GABA-A, producendo un effetto soppressivo sull’attività neuronale. In questo caso, invece di legarsi alla subunità gamma come nel caso delle benzodiazepine, l’acido valerenico sembra legarsi alla subunità beta del recettore GABA-A (47–50).
Sono ancora pochi gli studi clinici controllati condotti con la valeriana, tuttavia i risultati disponibili suggeriscono che il suo utilizzo facilita la ristrutturazione dell’architettura del sonno dopo diverse settimane di trattamento e, quindi, ne migliora la qualità. È inoltre dimostrato che svolge un ruolo importante nella riduzione dello stress di ansia nei pazienti in cui questa condizione interferisce con l’inizio e il mantenimento del sonno, nonché nel trattamento adiuvante nella sospensione dell’uso prolungato di benzodiazepine (51).
Diverse dichiarazioni sulla salute relative a questa pianta sono in fase di valutazione da parte dell’EFSA, ad esempio: aiuta a iniziare il sonno e a mantenerne la qualità (EFSA-Q-2008-3413, EFSA-Q-2008-4771) e fornisce supporto per il benessere mentale (EFSA-Q-2008-4932).
In 4Sleep, ogni capsula (che corrisponde alla dose giornaliera raccomandata), contiene 110 mg di estratto di radice di valeriana concentrato (3:1), che equivale a 330 mg di radice di valeriana secca per capsula.
Per vivere bene, devi dormire meglio!
1. Chaput, J.-P., et al. (2018). “Sleeping hours: what is the ideal number and how does age impact this?” Nature and Science of Sleep 10: 421-430.
2. Hood, S. D., et al. (2014). “Benzodiazepine dependence and its treatment with low dose flumazenil.” British Journal of Clinical Pharmacology 77(2): 285-294.
3. Ngo, D.-H.; Vo, T. S. Molecules (Basel, Switzerland) 2019, 24, 2678.
4. C. Furtado and I. Teixeira, Acta Médica Portuguesa, 2006, 19, 239-246.
5. Vaz, S. I. A. (2020). Avaliação da Utilização versus Uso Indevido de benzodiazepinas. Ciências da Saúde. Covilhã, Universidade da Beira Interior.
6. Tan, K. R., et al. (2010). “Neural bases for addictive properties of benzodiazepines.” Nature 463(7282): 769-774.
7. Carlini, E. A. (2003). “Plants and the central nervous system.” Pharmacology Biochemistry and Behavior 75(3): 501-512.
8. Sarris, J., et al. (2011). “Re-introduction of Kava (Piper methysticum) to the EU: Is There a Way Forward?” Planta Med 77(02): 107-110.
9. Arendt, J. Reviews of reproduction 1998, 3, 13.
10. Karasek, M. Experimental Gerontology 2004, 39, 1723.
11. Costello, R. B., et al. (2014). “The effectiveness of melatonin for promoting healthy sleep: a rapid evidence assessment of the literature.” Nutrition Journal 13(1): 106.
12. Ferracioli-Oda, E., et al. (2013). “Meta-analysis: melatonin for the treatment of primary sleep disorders.” PLOS ONE 8(5): e63773.
13. Hunter, C. M.; Figueiro, M. G. Biological research for nursing 2017, 19, 365.
14. Rzepka-Migut, B.; Paprocka, J. Brain sciences 2020, 10.
15. Hartley, S.; Dauvilliers, Y.; Quera-Salva, M.-A. Current Neurology and Neuroscience Reports 2018, 18, 65.
16. Cagnacci, A. Climacteric 2017, 20, 183.
17. Chojnacki, C.; Kaczka, A.; Gasiorowska, A.; Fichna, J.; Chojnacki, J.; Brzozowski, T. Journal of physiology and pharmacology : an official journal of the Polish Physiological Society 2018, 69.
18. Tan, D.-X. (2010). “Melatonin and brain.” Current neuropharmacology 8(3): 161-161.
19. Zisapel, N. (2018). “New perspectives on the role of melatonin in human sleep, circadian rhythms and their regulation.” British Journal of Pharmacology 175(16): 3190-3199.
20. Andersen, L. P., et al. (2016). “The Safety of Melatonin in Humans.” Clin Drug Investig 36(3): 169-175.
21. Gooneratne, N. S., et al. (2012). “Melatonin pharmacokinetics following two different oral surge-sustained release doses in older adults.” Journal of pineal research 52(4): 437-445.
22. Brzezinski, A., et al. (2005). “Effects of exogenous melatonin on sleep: a meta-analysis.” Sleep Medicine Reviews 9(1): 41-50.
23. Buscemi N, et al. (2004). “Melatonin for Treatment of Sleep Disorders: Summary.” In: AHRQ Evidence Report Summaries. Rockville (MD): Agency for Healthcare Research and Quality (US); 1998-2005. 108.
24. Buscemi, N., et al. (2005). “The efficacy and safety of exogenous melatonin for primary sleep disorders. A meta-analysis.” J Gen Intern Med 20(12): 1151-1158.
25. Buscemi, N., et al. (2006). “Efficacy and safety of exogenous melatonin for secondary sleep disorders and sleep disorders accompanying sleep restriction: meta-analysis.” BMJ (Clinical research ed.) 332(7538): 385-393.
26. Scientific Opinion on the substantiation of a health claim related to melatonin and reduction of sleep onset latency (ID 1698, 1780, 4080) pursuant to Article 13(1) of Regulation (EC) No 1924/2006 – 2011 – EFSA Journal.
27. Maffei, M. E. (2020) 5-Hydroxytryptophan (5-HTP): Natural Occurrence, Analysis, Biosynthesis, Biotechnology, Physiology and Toxicology. International journal of molecular sciences 22.
28. Birdsall, T. C. (1998). “5-Hydroxytryptophan: a clinically-effective serotonin precursor.” Altern Med Rev 3(4): 271-280.
29. Zagajewski, J., et al. (2012). “Conversion L-tryptophan to melatonin in the gastrointestinal tract: the new high performance liquid chromatography method enabling simultaneous determination of six metabolites of L-tryptophan by native fluorescence and UV-VIS detection.” J Physiol Pharmacol 63(6): 613-621.
30. Srivastava, J. K.; Shankar, E.; Gupta, S. Mol Med Rep 2010, 3, 895.
31. McKay, D. L. and J. B. Blumberg (2006). “A Review of the bioactivity and potential health benefits of chamomile tea (Matricaria recutita L.).” Phytotherapy Research 20(7): 519-530.
32. Venigalla, M., et al. (2015). “Curcumin and Apigenin – novel and promising therapeutics against chronic neuroinflammation in Alzheimer’s disease.” Neural regeneration research 10(8): 1181-1185.
33. Loggia, R. D., et al. (1982). “Depressive effects of Chamomilla recutita (L.) Rausch, tubular flowers, on central nervous system in mice.” Pharmacological Research Communications 14(2): 153-162.
34. Viola, H., et al. (1995). “Apigenin, a Component of Matricaria recutita Flowers, is a Central Benzodiazepine Receptors-Ligand with Anxiolytic Effects.” Planta Med 61(03): 213-216.
35. Avallone, R., et al. (2000). “Pharmacological profile of apigenin, a flavonoid isolated from Matricaria chamomilla.” Biochem Pharmacol 59(11): 1387-1394.
36. Salgueiro, J. B., et al. (1997). “Anxiolytic Natural and Synthetic Flavonoid Ligands of the Central Benzodiazepine Receptor Have No Effect on Memory Tasks in Rats.” Pharmacology Biochemistry and Behavior 58(4): 887-891.
37. Wasowski, C. and M. Marder (2012). “Flavonoids as GABAA receptor ligands: the whole story?” J Exp Pharmacol 4: 9-24.
38. Hanrahan, J. R., et al. (2011). “Flavonoid modulation of GABA(A) receptors.” British Journal of Pharmacology 163(2): 234-245.
39. Royal Society of New South, W. (2003). Dietary Chemicals and Brain Function. Journal and proceedings of the Royal Society of New South Wales. Sydney :, C. Potter, Acting. Govt. Printer. 135.
40. Houghton, P. J. (1999). “The scientific basis for the reputed activity of Valerian.” J Pharm Pharmacol 51(5): 505-512.
41. Andreatini, R., et al. (2002). “Effect of valepotriates (valerian extract) in generalized anxiety disorder: a randomized placebo-controlled pilot study.” Phytother Res 16(7): 650-654
42. Wasowski, C., et al. (2002). “Isolation and identification of 6-methylapigenin, a competitive ligand for the brain GABA(A) receptors, from Valeriana wallichii.” Planta Med 68(10): 934-936
43. Marder, M., et al. (2003). “6-Methylapigenin and hesperidin: new valeriana flavonoids with activity on the CNS.” Pharmacology Biochemistry and Behavior 75(3): 537-545
44. Fernández, S., et al. (2004). “Sedative and sleep-enhancing properties of linarin, a flavonoid-isolated from Valeriana officinalis.” Pharmacology Biochemistry and Behavior 77(2): 399-404.
45. Villar Del Fresno, Á. M. and M. E. Carretero Accame (2001). “Valeriana officinalis. Fitoquímica, farmacología y terapéutica.” Farmacia Profesional 15(9): 98-107.
46. Benke, D., et al. (2009). “GABA A receptors as in vivo substrate for the anxiolytic action of valerenic acid, a major constituent of valerian root extracts.” Neuropharmacology 56(1): 174-181.
47. Khom, S., et al. (2007). “Valerenic acid potentiates and inhibits GABAA receptors: Molecular mechanism and subunit specificity.” Neuropharmacology 53(1): 178-187.
48. Becker, A., et al. (2014). “The anxiolytic effects of a Valerian extract is based on valerenic acid.” BMC Complement Altern Med 14: 267-267.
49. Trauner, G., et al. (2008). “Modulation of GABAA receptors by valerian extracts is related to the content of valerenic acid.” Planta Med 74(1): 19-24.
50. Das, G., et al. (2021). “Plant Species of Sub-Family Valerianaceae-A Review on Its Effect on the Central Nervous System.” Plants (Basel) 10(5).
51. Shinjyo, N., et al. (2020). “Valerian Root in Treating Sleep Problems and Associated Disorders—A Systematic Review and Meta-Analysis.” Journal of Evidence-Based Integrative Medicine 25: 1-31