Una de las claves para una vida saludable es dormir bien por la noche. Es durante el sueño cuando nuestro cuerpo realiza sus principales funciones reparadoras, como la regeneración de los tejidos, el crecimiento muscular y la síntesis de proteínas. Durante este tiempo, es posible reponer energía y regular el metabolismo, factores esenciales para mantener un cuerpo y mente sanos y prevenir la aparición de enfermedades crónicas. El sueño también es importante para la regulación del apetito, ya que regula las hormonas relacionadas con el estrés (cortisol), lo que ayuda a controlar el peso y los niveles de glucosa en sangre.
¿Cuántas horas al día deberíamos dormir?
Las necesidades de sueño varían de persona a persona, sin embargo, existen valores medios definidos en función de la edad (Tabla 1). Por ejemplo, para los adultos, los expertos recomiendan un promedio de 7 a 9 horas de sueño al día en horarios regulares y sin interrupciones.
Tabela 1: Horas de sueño recomendadas según la edad (1)
| Valore medios para: | Horas de sueño/día |
| Recién nacidos | 14-17 |
| Bebés | 12-16 |
| Niños (1-2 años) | 11-14 |
| Niños en edad preescolar (3-5 años) | 10-13 |
| Niños en edad escolar (6-12 años) | 9-12 |
| Adolescentes | 8-10 |
| Adultos | 7-9 |
| Personas mayores (65+ años) | 7-8 |
Lamentablemente, en varios momentos de nuestra vida, dormir esta cantidad de horas y con la calidad necesaria es casi imposible y, especialmente deprimente, cuando se sufre de insomnio. El estrés y las preocupaciones del día a día pueden afectar negativamente los ritmos biológicos, dificultando el sueño y disminuyendo su calidad.
Las benzodiazepinas
Un recurso muy utilizado para el tratamiento de los trastornos graves del sueño y la ansiedad son los medicamentos psicoactivos a base de benzodiazepinas, como el Diazepam (Valium), el Alprazolan (Xanax), el Lorazepam (Ativan), el Estazolam (Prosom) y otros. Estos medicamentos deben usarse de forma racional y bajo estricta prescripción médica, ya que generan dependencia con mucha facilidad. De hecho, el uso de benzodiazepinas por un período de tiempo de aproximadamente 3 a 6 semanas, incluso usando dosis terapéuticas, conduce fácilmente a un estado de dependencia (2).
Estructuralmente (figura 1), las benzodiazepinas son el resultado de la fusión de un anillo de benceno (anillo A) con un anillo de 1,4-diazepina (anillo B). Las benzodiazepinas que expresan efectos anestésicos de forma más marcada tienen, además, un anillo arilo en la posición 5 (anillo C), lo que aumenta su potencia a nivel farmacológico. Las diferentes benzodiazepinas disponibles en el mercado tienen diferentes grupos químicos en las posiciones 1, 2, 5 o 7 y adicionalmente en 2′, que modulan las propiedades farmacológicas, la potencia del efecto y las condiciones farmacocinéticas (duración del efecto, distribución, etc).
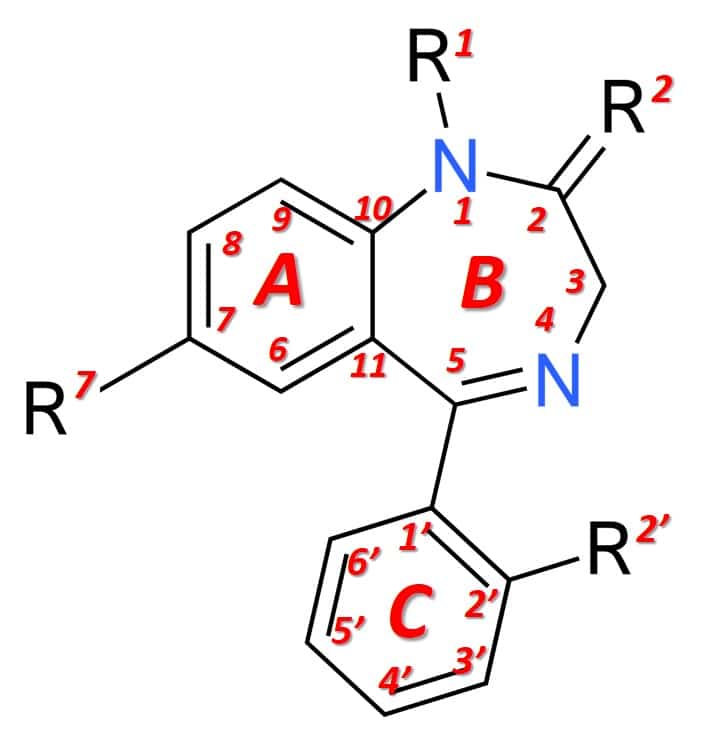
Figura 1: Estructura general de una benzodiazepina.
El mecanismo de acción de las benzodiazepinas
El ácido γ-aminobutírico (GABA) es el neurotransmisor inhibidor más importante del sistema nervioso central. La función de GABA es inhibir o reducir la actividad neuronal a través de su acción sobre receptores específicos denominados receptores GABA-A. Estos receptores son proteínas ubicadas en las membranas de las neuronas en los espacios sinápticos (el espacio entre una neurona presináptica y una postsináptica), donde ocurre la sinapsis química. Como consecuencia, la inhibición de la actividad neuronal produce una sensación de calma, relajación muscular y sedación, que juega un papel importante en el comportamiento, la cognición y la respuesta del organismo al estrés (3). Debido a su capacidad para unirse a ciertos sitios (subunidades alfa) ubicados en los receptores GABA-A, las benzodiazepinas modulan el efecto de GABA actuando como potenciadores de su efecto supresor sobre la actividad neuronal. Por este motivo, las benzodiazepinas son responsables de provocar efectos ansiolíticos (reductores de la ansiedad), hipnóticos (inductores del sueño), sedantes, anticonvulsivos y relajantes musculares.
El problema de salud pública generado por el consumo de benzodiazepinas
El principal problema asociado al consumo de benzodiazepinas es su capacidad para generar dependencia. Uno de los signos típicos del establecimiento de la dependencia en muchos pacientes es la aparición del síndrome de abstinencia, provocado tras una interrupción brusca de la ingesta crónica y prolongada de estas sustancias. Los síntomas típicos del síndrome de abstinencia son: ansiedad, ataques de pánico, hiperventilación, temblores, alteraciones del sueño, espasmos musculares, anorexia, pérdida de peso, alteraciones visuales, sudoración, disforia, hipersensibilidad al ruido, convulsiones, alucinaciones y delirios. Para complicar aún más la situación, en muchos países de Europa y especialmente en España (4,5), las benzodiazepinas suelen ser utilizadas de forma descontrolada por la población, dando lugar a un grave problema de salud pública que preocupa a las autoridades, ya que la adicción a esta sustancia es de difícil gestión terapéutica.
Las sensaciones placenteras que generan normalmente las drogas adictivas, e que son desastrosamente atractivas para las personas vulnerables, ocurren cuando los niveles de dopamina en el área de recompensa (o placer) del cerebro aumentan abruptamente. Estos tipos de medicamentos interfieren con los mecanismos naturales del cuerpo para controlar el flujo de dopamina. Más específicamente, las benzodiazepinas debilitan la acción de un grupo de neuronas llamadas interneuronas, que se encuentran en el área tegmental ventral del cerebro (VTA). Las interneuronas normalmente ayudan a prevenir niveles excesivos de dopamina regulando las tasas de activación de las neuronas productoras de dopamina. Por lo tanto, cuando las benzodiazepinas limitan la influencia restrictiva de las interneuronas, las neuronas productoras de dopamina liberan más dopamina de lo normal (6).
La dopamina es la sustancia química que media el placer en el cerebro. Su producción se desarrolla en situaciones placenteras y tiene como objetivo estimular la realización de actividades placenteras, importantes para la supervivencia, como la comida o el sexo. Algunos fármacos como los opioides y las benzodiazepinas tienen la capacidad de estimular artificialmente la producción de dopamina en el cerebro, dando lugar a desequilibrios en el proceso natural de recompensa/supervivencia.
Alternativas naturales a las benzodiazepinas
Dado que no se espera que disminuyan los factores responsables de la ansiedad y el insomnio, es fundamental para la calidad de vida del paciente encontrar alternativas ansiolíticas con menor potencial de inducir reacciones adversas. En este sentido, ha existido un gran interés por parte de la comunidad científica en el estudio de las plantas medicinales (7). Desde la antigüedad, algunas plantas se han utilizado para tratar el insomnio y la ansiedad y, en la actualidad, el uso de sus extractos ha ganado una aceptación cada vez mayor por parte de la comunidad médica (7). Sin embargo, la mayoría de las plantas medicinales carecen de datos químicos y farmacológicos y, en muchos casos, sus principios activos aún no se han identificado ni estudiado químicamente. Se espera que con el avance de los estudios científicos en el área de la fitoquímica y la fitomedicina, dispongamos de una mayor cantidad de recursos naturales para ayudar en el tratamiento de este tipo de trastornos.
Entre las diversas plantas medicinales conocidas por sus propiedades ansiolíticas, sedantes y relajantes, podemos destacar la kava-kava (Piper methysticum), la pasiflora (Passiflora incarnata), la grifonia (Griffonia simpliciflia), la valeriana (Valeriana officinalis), la manzanilla (Matricaria recutita) y la arnica (Galphimia glauca). Estas plantas han sido ampliamente estudiadas y se han identificado sus ingredientes activos más importantes. Entre los ejemplos citados, la kava-kava dejó de estar autorizada como ingrediente en complementos alimenticios en Europa a partir de 2002, debido a la sospecha de hepatotoxicidad (8).
4Sleep: 4 ingredientes poderosos para ayudarte a dormir mejor
Consciente de la necesidad de ofrecer alternativas seguras para ayudar a las personas que sufren de insomnio y tienen dificultades para conciliar el sueño, Nutribiolite ha desarrollado 4Sleep, un complemento alimenticio que combina melatonina y los extractos concentrados de grifonia, valeriana y manzanilla. Cada uno de estos ingredientes ha demostrado, en varios trabajos científicos, presentar importantes propiedades ansiolíticas que ayudan a promover los procesos biológicos asociados a la relajación y la conciliación del sueño. La combinación de estos ingredientes tiene como objetivo obtener un efecto aditivo que proporcione un efecto inductor del sueño progresivo y duradero. En los siguientes capítulos, proporcionamos un breve resumen de las propiedades de cada uno de estos ingredientes de 4Sleep.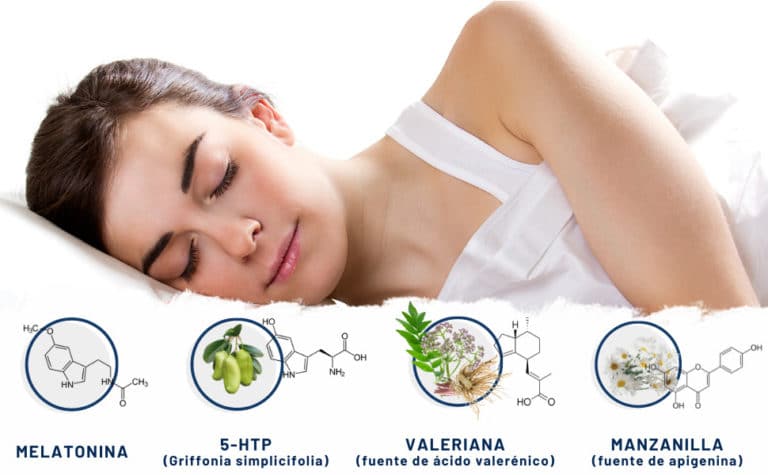
Melatonina
La melatonina, o N-acetil-5-metoxitriptamina, es una hormona producida principalmente por la glándula pineal (ubicada en la parte posterior del cerebro) a partir del aminoácido triptófano y derivada de otra hormona, la serotonina. La melatonina es extremadamente importante para regular el reloj biológico del cuerpo (ciclo circadiano o ciclo de sueño-vigilia) y el metabolismo energético. Esta hormona se produce cuando la retina detecta la ausencia de luz, de tal forma que su biosíntesis diaria obedece precisamente a una producción rítmica circadiana sincronizada con el ciclo de luz ambiental característico del día y la noche. Esta producción rítmica diaria es tal que, en cualquier especie considerada, el pico de producción se da durante la noche. Otra característica importante del sistema neural funcional que regula la síntesis de melatonina es que la luz presente en el ambiente durante la noche puede bloquear por completo (dependiendo de su intensidad y longitud de onda, principalmente luz azul de 480 nm), la síntesis de melatonina pineal (9). Por ello, la ausencia total de luz artificial es importante para conciliar el sueño. Hábitos como usar un teléfono inteligente u otro dispositivo electrónico con pantallas luminiscentes dificultan la creación de los mecanismos biológicos que desencadenan la producción natural de melatonina.
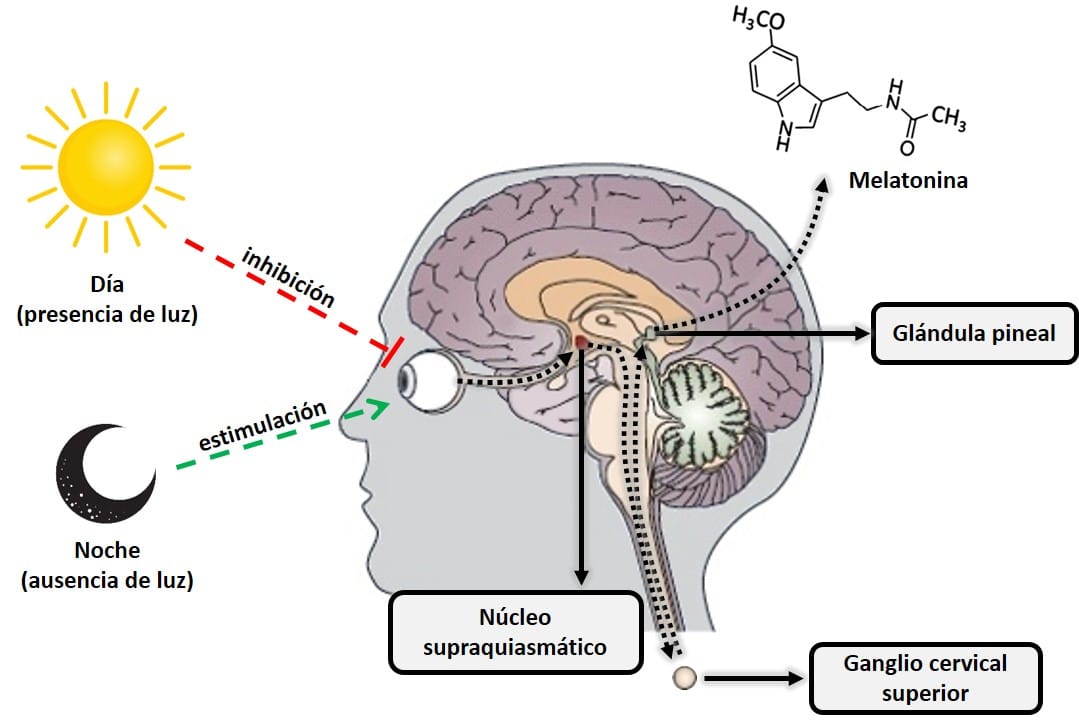
Figura 2: Esquema de los procesos que inhiben y estimulan la producción pineal de melatonina.
La cantidad de melatonina no es constante durante toda la vida. Su producción se inicia en bebés a partir de los 3-4 meses de edad y sus niveles aumentan a lo largo de la infancia hasta alcanzar un valor máximo entre los 8-10 años. A partir de ahí, su producción comienza a decaer, proceso que se seguirá hasta el final de su vida. Cuando llegamos a los 40-45 años, la disminución en la producción de melatonina pasa a ser más abrupta. En personas mayores de 70 años, los niveles de melatonina ya están por debajo del 10% de los valores típicamente observados en niños de entre 8 y 10 años (10).
Según varios estudios científicos, la suplementación oral con melatonina es beneficiosa y ayuda a reducir el tiempo necesario para conciliar el sueño (11, 12), ayuda a reducir los trastornos del sueño relacionados con el desfase horario en los trabajadores nocturnos (13), en los trastornos por déficit de atención con hiperactividad (TDAH) (14), cambios en el ritmo circadiano en personas ciegas (15) y problemas de sueño derivados de la menopausia (16, 17). La melatonina atraviesa fácilmente la barrera hematoencefálica y se acumula en el sistema nervioso central a niveles sustancialmente más altos que los que se encuentran en la sangre (18). En este sentido, la suplementación con melatonina (exógena) es bastante eficaz, especialmente en individuos con niveles bajos de melatonina endógena (19). Debido a la fácil acumulación de melatonina en el cerebro, no se recomienda tomar altas cantidades diarias de esta substancia, especialmente en personas mayores, debido a la disminución de la función hepática y renal, así como a los cambios en la composición corporal (retención de grasa y agua) que alteran las propiedades farmacocinéticas de la melatonina y aumentan el riesgo de efectos adversos como somnolencia al día siguiente (20, 21).
Teniendo en cuenta la búsqueda de una mejor relación riesgo/beneficio para los consumidores europeos, en 2001, a petición de la Comisión Europea, el Panel de Productos Dietéticos, Nutrición y Alergias de la Autoridad Europea de Seguridad Alimentaria (EFSA) emitió un dictamen científico sobre los beneficios propiedades de la melatonina para dormir y qué cantidades serían ideales para obtener estos beneficios. El panel consideró varios estudios de metanálisis controlados con placebo en personas sin problemas de sueño, en personas con trastornos primarios del sueño y en personas con insomnio (26). Según esta revisión científica, la EFSA concluyó que la cantidad de 1 mg de melatonina consumida antes de acostarse ayuda eficazmente a la recuperación del sueño (22–25). Como resultado, varios países europeos han establecido límites a la dosis diaria máxima autorizada de melatonina en complementos alimenticios, por ejemplo: España (1,9 mg), Portugal (1,9 mg), Grecia (3,0 mg), Francia (2,0 mg), Países Bajos (0,3 mg) e Italia (1 mg). A partir de estos valores, la melatonina se considera un fármaco y su venta está controlada por prescripción médica y solo indicada para personas diagnosticadas clínicamente con déficit de melatonina endógena.
Basado en el informe científico de la EFSA y cumpliendo con la normativa de todos los países europeos en los que Nutribiolite comercializa sus productos, 4Sleep incorpora exactamente 1 mg de melatonina en su fórmula. De hecho, una cantidad mayor (hasta 1,9 mg) de este principio activo es innecesaria, según varios estudios de metaanálisis (22–25). Además, el proceso de conciliación del sueño también depende de otros mecanismos de relajación que se desencadenan en el sistema nervioso central, por lo que 4Sleep se basa en la combinación de la melatonina con otros tres principios activos obtenidos de las plantas medicinales Griffonia, Valeriana y Manzanilla que describimos. a continuación. 4Sleep presenta en su fórmula 1 mg de melatonina.
La melatonina contribuye a aliviar la sensación subjetiva de desfase horario (jet lag). El efecto beneficioso se obtiene con una ingesta mínima de 0,5 mg que debe tomarse poco antes de acostarse el primer día de viaje y unos cuantos días después de la llegada a lugar de destino1.
La melatonina contribuye a disminuir el tiempo necesario para conciliar el sueño. El efecto beneficioso se obtiene con una ingesta de 1 mg de melatonina poco antes de irse a dormir1.
La Griffonia: fuente de 5HTP, aminoácido precursor de serotonina y melatonina
Otro ingrediente activo presente en la fórmula 4Sleep es el L-5-hidroxitriptófano, también conocido como 5HTP, un aminoácido precursor e intermedio en la biosíntesis de los neurotransmisores serotonina y melatonina (figura 3). La existencia de 5HTP en la naturaleza no solo se limita a los mamíferos, como los humanos, sino que también es producida por plantas, hongos y microbios. La semilla de la Griffonia (Griffonia simplicifolia) es una de las fuentes vegetales más ricas en 5HTP, lo que ha llevado al desarrollo de métodos muy robustos tanto para la producción de extractos concentrados como para su caracterización analítica. En consecuencia, tanto los laboratorios farmacéuticos como los laboratorios de fabricación de complementos alimenticios tienen actualmente a su disposición extractos de Griffonia estandarizados en términos de 5HTP de excelente calidad (27). 4Sleep utiliza un extracto de altamente concentrado en 5HTP (> 20%), determinado por cromatografía líquida de alta resolución (HPLC).
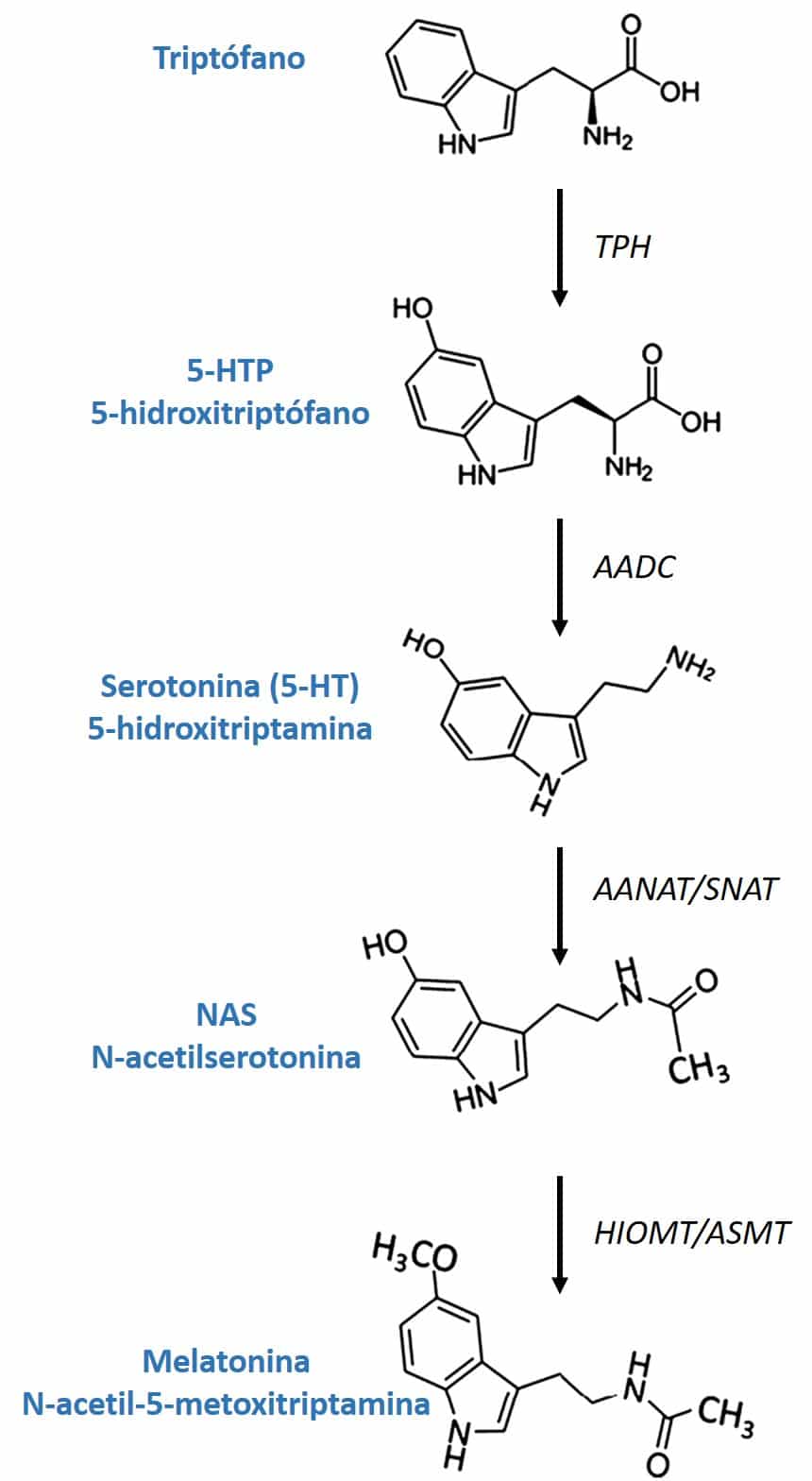
Figura 3: Biosíntesis de la melatonina.
La conversión de 5-HTP en serotonina en el cuerpo se lleva a cabo a través de la enzima AADC (aromática L-aminoácido descarboxilasa). Su conversión a melatonina involucra dos enzimas que son producidas por la glándula pineal luego de ser inducidas por la retina por falta de luz: la enzima SNAT (serotonina-N-acetiltransferasa) convierte la serotonina en N-acetilserotonina y la enzima (HIOMT) hidroxiindol- O-metiltrasferasa transfiere un grupo metilo de la S-adenosilmetionina al 5-hidroxilo de la N-acetilserotonina, dando lugar a la melatonina.
La serotonina y la melatonina son casi literalmente día y noche en términos hormonales. Estas dos hormonas realizan un trabajo opuesto, pero en completa armonía, para mantener el cuerpo en equilibrio. La serotonina, conocida como la «hormona de la felicidad», es un neurotransmisor que juega un papel clave en la regulación de casi todas las funciones del sistema nervioso central, como el estado de ánimo, la ansiedad, el estrés, el hambre, la cognición y el comportamiento sexual. A diferencia de la melatonina, la serotonina tiene su producción máxima durante el día, cuando la retina detecta la presencia de luz. Su producción tiene lugar principalmente en un área del cerebro llamada núcleos del rafe.
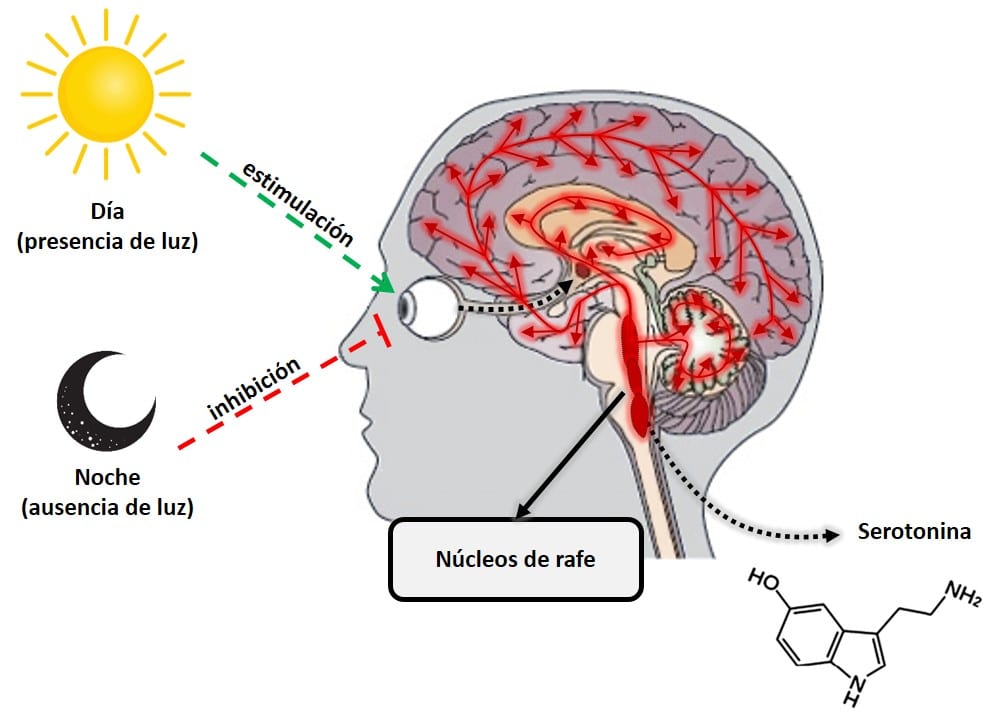
Figura 3: Producción de serotonina.
La función del 5-HTP en 4Sleep es proporcionar una fuente secundaria de melatonina, que se producirá gradualmente a través de la serotonina durante la noche. De hecho, varios estudios científicos han encontrado que la administración de 5-HTP, además de aumentar los niveles de serotonina, también produjo un aumento en los niveles de melatonina (28).
La conversión de 5-HTP en serotonina en el cuerpo se lleva a cabo a través de la enzima AADC (aromática L-aminoácido descarboxilasa). Su conversión a melatonina involucra dos enzimas que son producidas por la glándula pineal luego de ser inducidas por la retina por falta de luz: la enzima SNAT (serotonina-N-acetiltransferasa) convierte la serotonina en N-acetilserotonina y la enzima (HIOMT) hidroxiindol- O-metiltrasferasa transfiere un grupo metilo de la S-adenosilmetionina al 5-hidroxilo de la N-acetilserotonina, dando lugar a la melatonina.
4Sleep presenta en su fórmula 245 mg de un extracto de Griffonia simplicifolia, estandarizado al 20% en 5HTP, lo que corresponde a 49 mg de 5HTP por dosis diaria recomendada.
Manzanilla
Una característica de las plantas medicinales es el hecho de que casi siempre están formadas por una mezcla variada de principios activos, lo que hace que una misma especie vegetal presente varias propiedades medicinales diferentes. La manzanilla o Matricaria chamomilla L. (también conocida como Chamomilla recutita o Matricaria recutita) (figura 4) es un claro ejemplo de ello. Esta planta herbácea originaria de Europa y Asia Occidental tiene varios usos medicinales, incluido su uso como antiinflamatorio, antibacteriano, digestivo, ansiolítico, antiespasmódico y anticonvulsivo (30, 31). La parte más utilizada de la planta son sus flores, compuestas por varios compuestos fenólicos, principalmente los flavonoides apigenina, quercetina, patuletina, luteolina y sus glucósidos (31). En cuanto a las propiedades ansiolíticas de la manzanilla, estas se deben a la presencia de apigenina, un polifenol flavonoide muy abundante en las flores de esta planta y que constituye el 68% de su contenido total de flavonoides (32).

Figura 4: La flor de manzanilla.
Las propiedades ansiolíticas de la manzanilla fueron estudiadas por primera vez en 1982 por el grupo del Dr. Roberto DellaLoggia de la Facultad de Farmacia de la Universidad de Trieste (33). Utilizando un modelo animal con ratas, se observó que la administración de una infusión de manzanilla logró ejercer una acción depresiva sobre el sistema nervioso central de los animales, al reducir el ritmo basal e inducir el sueño. También se observó que la intensidad de estos efectos dependía de la concentración de la infusión utilizada, lo que también corroboró que los efectos ansiolíticos observados provenían de la administración de manzanilla. Después de este estudio, siguieron muchos otros, pero ahora con el objetivo de identificar el componente de la planta responsable de esta propiedad. En 1995, Viola y colaboradores demostraron que la flor de manzanilla contiene varias moléculas capaces de unirse competitivamente a los mismos sitios de unión que las benzodiazepinas, entre las que destaca la apigenina, que presentó a una clara actividad ansiolítica en ratas (34). En otras palabras, este estudio sugere que la apigenina podría tener propiedades similares a las benzodiazepinas, al unirse a los mismos sitios de unión utilizados por las benzodiazepinas en los receptores GABA-A. Estudios posteriores indican que los efectos de la apigenina sobre los receptores GABA-A son todavía más complejos y que otros receptores pueden estar involucrados en sus efectos ansiolíticos (35–37). Lo más probable es que la apigenina actúe como un modulador de segundo orden de los receptores GABA-A, en este caso aumentando el efecto de un modulador de primer orden. Las actividades sedantes y ansiolíticas de la apigenina observadas en ratas (34,35) se pueden interpretar en base a la apigenina potenciando la acción de agentes endógenos similares a las benzodiazepinas en las neuronas (38, 39).
Debido a las propiedades medicinales beneficiosas de las flores de manzanilla, la Autoridad Europea de Seguridad Alimentaria (EFSA) está evaluando actualmente varias declaraciones de salud relacionadas con la manzanilla como su contribución a la relajación (EFSA-Q-2010-00538) y al mantenimiento de un sueño saludable (EFSA-Q-2010-00586).
4Sleep presenta en su fórmula 108 mg de un extracto de Manzanilla (Matricaria chamomilla), estandarizado al 1,2% en apigenina.
Valeriana
La valeriana (Valeriana officinalis L.), una planta perenne originaria de América del Norte, Asia y Europa, es también otra especie tradicionalmente utilizada por sus propiedades ansiolíticas (40) (figura 5). De hecho, es una de las especies más utilizadas y una de las que más estudios se han realizado para comprobar sus efectos en el tratamiento del insomnio y otros síntomas asociados al nerviosismo. La parte más utilizada de la planta es su raíz, formada por varios sesquiterpenoides e iridoides. Los compuestos activos más importantes de la raíz de valeriana son los valepotriatos (un iridoide) y el ácido valerénico (un sesquiterpenoide). Originalmente se pensaba que solo los valepotriatos eran responsables de los efectos sedantes de la valeriana, sin embargo, los extractos puramente acuosos de valeriana, como los obtenidos en infusiones (tés), también han demostrado tener un efecto sedante (40, 41). Como los valepotriatos no son solubles en agua, se concluyó que el ácido valerénico presente en la raíz de valeriana también tenía propiedades ansiolíticas y era el principal componente químico responsable del efecto observado en ensayos clínicos con humanos. Además de los valepotriatos y el ácido valerénico, en 2002 se aisló por primera vez el flavonoide 6-metilapigenina y se demostró que esta molécula era capaz de unirse a los receptores GABA-A, produciendo un efecto ansiolítico similar al de las benzodiazepinas (42). En los años siguientes se aislaron los glucósidos hesperidina (43) y linarina (44), que también son capaces de unirse a los receptores GABA-A, presentando propiedades sedantes e hipnóticas. Además, el efecto de la hesperidina fue mejorado sinérgicamente por la 6-metilapigenina y el de la linarina por el ácido valerénico presente en la composición de valeriana.

Figura 5: Raíz de valeriana.
Los valepotriatos mostraron citotoxicidad en estudios in vitro, aunque esto no se ha demostrado en estudios in vivo. Debido a la alta inestabilidad química de los valepotriatos, apenas se encuentran en preparados fitofarmacéuticos comerciales como los complementos alimenticios y, además, tienen baja absorción (45). De todos modos, los extractos de valeriana utilizados en complementos alimenticios se obtienen mediante una mezcla controlada de agua/bioetanol para no extraer valepotriatos.
El extracto de valeriana de 4Sleep está certificado por laboratorios acreditados y no contiene valepotriatos. El requisito de este certificado es uno de los criterios necesarios para su comercialización en Europa.
De todos los componentes de la valeriana, el que ejerce el efecto ansiolítico más importante es el ácido valerénico (46). Además, de todas las sustancias identificadas en la valeriana que poseen esta propiedad, el ácido valerénico es el que está presenta en mayor cantidad en la planta. Esta sustancia también tiene la capacidad de modular los receptores GABA-A, produciendo un efecto supresor de la actividad neuronal. En este caso, en lugar de unirse a la subunidad gamma como en el caso de las benzodiazepinas, el ácido valerénico parece unirse a la subunidad beta del receptor GABA-A (47–50).
Aún existen pocos estudios clínicos controlados realizados con valeriana, sin embargo, los resultados disponibles sugieren que su uso facilita la reestructuración de la arquitectura del sueño tras varias semanas de tratamiento y, por tanto, mejora su calidad. También hay evidencia de que juega un papel importante en la reducción del estrés por ansiedad en pacientes en los que esta condición interfiere con el inicio y mantenimiento del sueño, así como en el tratamiento adyuvante en la suspensión del uso prolongado de benzodiazepinas (51).
La EFSA está evaluando varias declaraciones de salud con respecto a esta planta, por ejemplo: ayuda a iniciar el sueño y a mantener su calidad (EFSA-Q-2008-3413, EFSA-Q-2008-4771) y apoya el bienestar mental (EFSA-Q-2008-4932).
En 4Sleep, cada cápsula (cantidad diaria recomendada) contiene 110 mg de concentrado de extracto de raíz de valeriana (3:1), lo que equivale a 330 mg de raíz de valeriana seca por cápsula.
4Sleep presenta en su fórmula 125 mg de un extracto de Valeriana (Valeriana officinalis), estandarizado al 0,8% en ácido valerénico.
¡Para vivir bien, hay que dormir mejor!
1. Chaput, J.-P., et al. (2018). “Sleeping hours: what is the ideal number and how does age impact this?” Nature and Science of Sleep 10: 421-430.
2. Hood, S. D., et al. (2014). “Benzodiazepine dependence and its treatment with low dose flumazenil.” British Journal of Clinical Pharmacology 77(2): 285-294.
3. Ngo, D.-H.; Vo, T. S. Molecules (Basel, Switzerland) 2019, 24, 2678.
4. El consumo de ansiolíticos en 2020 fue el más alto de la última década (elconfidencial.com)
5. Utilización de medicamentos ansiolíticos e hipnóticos en España – Agencia Española de Medicamentos y Productos Sanitarios (aemps.gob.es)
6. Tan, K. R., et al. (2010). “Neural bases for addictive properties of benzodiazepines.” Nature 463(7282): 769-774.
7. Carlini, E. A. (2003). “Plants and the central nervous system.” Pharmacology Biochemistry and Behavior 75(3): 501-512.
8. Sarris, J., et al. (2011). “Re-introduction of Kava (Piper methysticum) to the EU: Is There a Way Forward?” Planta Med 77(02): 107-110.
9. Arendt, J. Reviews of reproduction 1998, 3, 13.
10. Karasek, M. Experimental Gerontology 2004, 39, 1723.
11. Costello, R. B., et al. (2014). “The effectiveness of melatonin for promoting healthy sleep: a rapid evidence assessment of the literature.” Nutrition Journal 13(1): 106.
12. Ferracioli-Oda, E., et al. (2013). “Meta-analysis: melatonin for the treatment of primary sleep disorders.” PLOS ONE 8(5): e63773.
13. Hunter, C. M.; Figueiro, M. G. Biological research for nursing 2017, 19, 365.
14. Rzepka-Migut, B.; Paprocka, J. Brain sciences 2020, 10.
15. Hartley, S.; Dauvilliers, Y.; Quera-Salva, M.-A. Current Neurology and Neuroscience Reports 2018, 18, 65.
16. Cagnacci, A. Climacteric 2017, 20, 183.
17. Chojnacki, C.; Kaczka, A.; Gasiorowska, A.; Fichna, J.; Chojnacki, J.; Brzozowski, T. Journal of physiology and pharmacology : an official journal of the Polish Physiological Society 2018, 69.
18. Tan, D.-X. (2010). “Melatonin and brain.” Current neuropharmacology 8(3): 161-161.
19. Zisapel, N. (2018). “New perspectives on the role of melatonin in human sleep, circadian rhythms and their regulation.” British Journal of Pharmacology 175(16): 3190-3199.
20. Andersen, L. P., et al. (2016). “The Safety of Melatonin in Humans.” Clin Drug Investig 36(3): 169-175.
21. Gooneratne, N. S., et al. (2012). “Melatonin pharmacokinetics following two different oral surge-sustained release doses in older adults.” Journal of pineal research 52(4): 437-445.
22. Brzezinski, A., et al. (2005). “Effects of exogenous melatonin on sleep: a meta-analysis.” Sleep Medicine Reviews 9(1): 41-50.
23. Buscemi N, et al. (2004). “Melatonin for Treatment of Sleep Disorders: Summary.” In: AHRQ Evidence Report Summaries. Rockville (MD): Agency for Healthcare Research and Quality (US); 1998-2005. 108.
24. Buscemi, N., et al. (2005). “The efficacy and safety of exogenous melatonin for primary sleep disorders. A meta-analysis.” J Gen Intern Med 20(12): 1151-1158.
25. Buscemi, N., et al. (2006). “Efficacy and safety of exogenous melatonin for secondary sleep disorders and sleep disorders accompanying sleep restriction: meta-analysis.” BMJ (Clinical research ed.) 332(7538): 385-393.
26. Scientific Opinion on the substantiation of a health claim related to melatonin and reduction of sleep onset latency (ID 1698, 1780, 4080) pursuant to Article 13(1) of Regulation (EC) No 1924/2006 – 2011 – EFSA Journal.
27. Maffei, M. E. (2020) 5-Hydroxytryptophan (5-HTP): Natural Occurrence, Analysis, Biosynthesis, Biotechnology, Physiology and Toxicology. International journal of molecular sciences 22.
28. Birdsall, T. C. (1998). “5-Hydroxytryptophan: a clinically-effective serotonin precursor.” Altern Med Rev 3(4): 271-280.
29. Zagajewski, J., et al. (2012). “Conversion L-tryptophan to melatonin in the gastrointestinal tract: the new high performance liquid chromatography method enabling simultaneous determination of six metabolites of L-tryptophan by native fluorescence and UV-VIS detection.” J Physiol Pharmacol 63(6): 613-621.
30. Srivastava, J. K.; Shankar, E.; Gupta, S. Mol Med Rep 2010, 3, 895.
31. McKay, D. L. and J. B. Blumberg (2006). “A Review of the bioactivity and potential health benefits of chamomile tea (Matricaria recutita L.).” Phytotherapy Research 20(7): 519-530.
32. Venigalla, M., et al. (2015). “Curcumin and Apigenin – novel and promising therapeutics against chronic neuroinflammation in Alzheimer’s disease.” Neural regeneration research 10(8): 1181-1185.
33. Loggia, R. D., et al. (1982). “Depressive effects of Chamomilla recutita (L.) Rausch, tubular flowers, on central nervous system in mice.” Pharmacological Research Communications 14(2): 153-162.
34. Viola, H., et al. (1995). “Apigenin, a Component of Matricaria recutita Flowers, is a Central Benzodiazepine Receptors-Ligand with Anxiolytic Effects.” Planta Med 61(03): 213-216.
35. Avallone, R., et al. (2000). “Pharmacological profile of apigenin, a flavonoid isolated from Matricaria chamomilla.” Biochem Pharmacol 59(11): 1387-1394.
36. Salgueiro, J. B., et al. (1997). “Anxiolytic Natural and Synthetic Flavonoid Ligands of the Central Benzodiazepine Receptor Have No Effect on Memory Tasks in Rats.” Pharmacology Biochemistry and Behavior 58(4): 887-891.
37. Wasowski, C. and M. Marder (2012). “Flavonoids as GABAA receptor ligands: the whole story?” J Exp Pharmacol 4: 9-24.
38. Hanrahan, J. R., et al. (2011). “Flavonoid modulation of GABA(A) receptors.” British Journal of Pharmacology 163(2): 234-245.
39. Royal Society of New South, W. (2003). Dietary Chemicals and Brain Function. Journal and proceedings of the Royal Society of New South Wales. Sydney :, C. Potter, Acting. Govt. Printer. 135.
40. Houghton, P. J. (1999). “The scientific basis for the reputed activity of Valerian.” J Pharm Pharmacol 51(5): 505-512.
41. Andreatini, R., et al. (2002). “Effect of valepotriates (valerian extract) in generalized anxiety disorder: a randomized placebo-controlled pilot study.” Phytother Res 16(7): 650-654
42. Wasowski, C., et al. (2002). “Isolation and identification of 6-methylapigenin, a competitive ligand for the brain GABA(A) receptors, from Valeriana wallichii.” Planta Med 68(10): 934-936
43. Marder, M., et al. (2003). “6-Methylapigenin and hesperidin: new valeriana flavonoids with activity on the CNS.” Pharmacology Biochemistry and Behavior 75(3): 537-545
44. Fernández, S., et al. (2004). “Sedative and sleep-enhancing properties of linarin, a flavonoid-isolated from Valeriana officinalis.” Pharmacology Biochemistry and Behavior 77(2): 399-404.
45. Villar Del Fresno, Á. M. and M. E. Carretero Accame (2001). “Valeriana officinalis. Fitoquímica, farmacología y terapéutica.” Farmacia Profesional 15(9): 98-107.
46. Benke, D., et al. (2009). “GABA A receptors as in vivo substrate for the anxiolytic action of valerenic acid, a major constituent of valerian root extracts.” Neuropharmacology 56(1): 174-181.
47. Khom, S., et al. (2007). “Valerenic acid potentiates and inhibits GABAA receptors: Molecular mechanism and subunit specificity.” Neuropharmacology 53(1): 178-187.
48. Becker, A., et al. (2014). “The anxiolytic effects of a Valerian extract is based on valerenic acid.” BMC Complement Altern Med 14: 267-267.
49. Trauner, G., et al. (2008). “Modulation of GABAA receptors by valerian extracts is related to the content of valerenic acid.” Planta Med 74(1): 19-24.
50. Das, G., et al. (2021). “Plant Species of Sub-Family Valerianaceae-A Review on Its Effect on the Central Nervous System.” Plants (Basel) 10(5).
51. Shinjyo, N., et al. (2020). “Valerian Root in Treating Sleep Problems and Associated Disorders—A Systematic Review and Meta-Analysis.” Journal of Evidence-Based Integrative Medicine 25: 1-31