4 ingredientes poderosos para ajudar a dormir melhor
Um dos segredos para uma vida saudável é ter boas noites de sono. É durante o sono que o nosso organismo exerce as suas principais funções restauradoras, como a reparação dos tecidos, o crescimento muscular e a síntese de proteínas. Durante este momento, é possível repor energias e regular o metabolismo, fatores essenciais para manter corpo e mente saudáveis e prevenir o aparecimento de doenças cronicas. Dormir é também importante para a regulação do apetite, pois regula as hormonas relacionadas com o stress (cortisol), ajudando no controlo do peso e dos níveis de glicose no sangue.
Quantas horas por dia deveríamos dormir?
As necessidades de sono variam de pessoa para pessoa, no entanto, existem valores médios definidos em função da idade (tabela 1). Por exemplo, no caso de adultos, os especialistas recomendam em média 7 a 8 horas de sono por dia em horários regulares e sem interrupções.
Tabela 1: Horas recomendadas de sono em função da idade (1)
| Valore médios para: | Horas de sono/dia |
| Recém-nascidos | 14-17 |
| Bebés | 12-16 |
| Crianças (1-2 anos) | 11-14 |
| Crianças em idade pré-escolar (3-5 anos) | 10-13 |
| Crianças em idade escolar (6-12 anos) | 9-12 |
| Adolescentes | 8-10 |
| Adultos | 7-9 |
| Idosos (65+ anos) | 7-8 |
Infelizmente, em vários momentos da nossa vida, conseguir dormir esta quantidade de horas e com a necessária qualidade é quase impossível e especialmente deprimente quando se sofre de insónias. O stress e as preocupações do dia-a-dia podem afetar negativamente os ritmos biológicos, dificultando o sono e diminuindo a sua qualidade.
As benzodiazepinas
Um recurso muito utilizado para tratamentos de transtornos graves do sono e ansiedade, são os medicamentos psicoativos baseados em benzodiazepinas, como o diazepam (Valium), alprazolan (Xanax), lorazepam (Ativan), estazolam (Prosom) e outros. Estes medicamentos devem ser utilizados de maneira racional e sob um restrito seguimento da prescrição médica, pois geram dependência muito facilmente. Com efeito, o uso de benzodiazepinas por um período de tempo de aproximadamente, 3 a 6 semanas, mesmo utilizando doses terapêuticas, conduz facilmente a um estado de dependência (2).
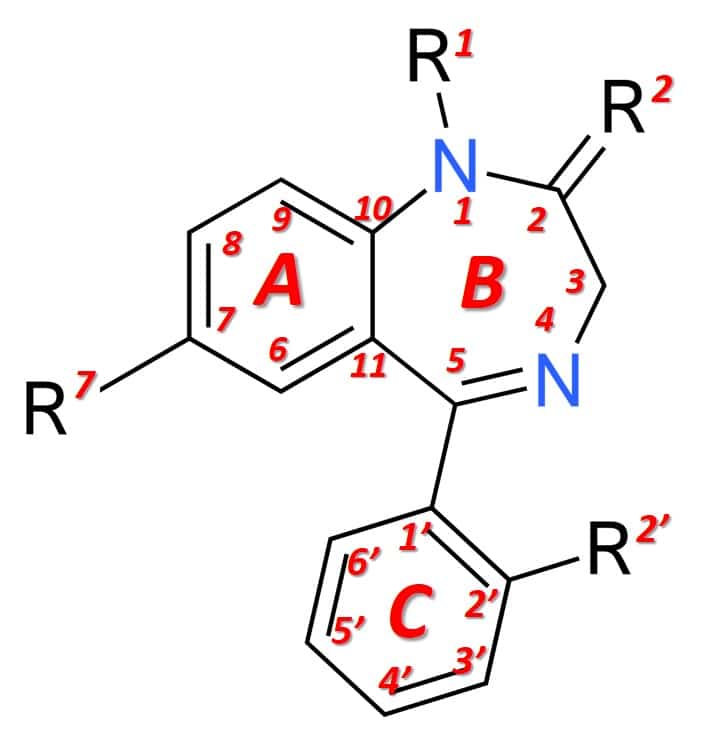
Estruturalmente (figura 1), as benzodiazepinas são o resultado da fusão de um anel benzeno (anel A) com um anel de 1,4-diazepina (anel B). As benzodiazepinas que expressam efeitos anestésicos de forma mais marcada apresentam, adicionalmente, um anel arilo na posição 5 (anel C), o que incrementa a sua potência a nível farmacológico. As diferentes benzodiazepinas disponíveis no mercado apresentam distintos grupos químicos nas posições 1, 2, 5 ou 7 e adicionalmente em 2′, que modulam as as propriedades farmacológicas, a potência do efeito e as condições farmacocinéticas (duração do efeito, distribuição, etc).
Figura 1: Estrutura geral das benzodiazepinas.
O mecanismo de ação das benzodiazepinas
O ácido γ-aminobutírico (GABA) é o mais importante neurotransmissor inibidor no sistema nervoso central. A função do GABA é inibir ou reduzir a atividade neuronal a traves da sua ação em recetores específicos denominados recetores GABA-A. Estes recetores são proteínas localizadas nas membranas dos neurónios nos espaços sinápticos (espaço entre um neurónio pré-sinápticos e um pós-sináptico), onde ocorre a sinapse química. Como consequência, a inibição da atividade neuronal produz sensação de calma, relaxamento muscular e sedação, o que desempenha um papel importante no comportamento, na cognição e na resposta do corpo ao stress (3). Devido a capacidade que têm de se unir a determinados sítios (subunidades alfa) localizadas nos recetores GABA-A, as benzodiazepinas modulam o efeito do GABA atuando como potenciadoras do seu efeito supressor da atividade neuronal. Por este motivo, as benzodiazepinas são responsáveis por causar efeitos ansiolíticos (diminuição da ansiedade), hipnóticos (indutoras de sono), sedativos, anti convulsionantes e de relaxamento muscular.
O problema de saúde pública gerado pelo consumo das benzodiazepinas
O principal problema associado ao consumo de benzodiazepinas é a sua capacidade de gerar dependência. Um dos sinais típicos do estabelecimento de dependência em muitos pacientes é a ocorrência da síndrome de abstinência, ocasionada depois de uma interrupção abrupta da toma crónica e prolongada destas substancias. Os sintomas típicos da síndrome de abstinência são: ansiedade, ataques de pânico, hiperventilação, tremores, perturbações no sono, espasmos musculares, anorexia, perda de peso, distúrbios visuais, suores, disforia, hipersensibilidade ao ruído, convulsões, alucinações e delírios. Para complicar ainda mais a situação, em muitos países da Europa e especialmente em Portugal (4,5), as benzodiazepinas são frequentemente utilizadas de maneira descontrolada pela população, dando origem a um grave problema de saúde publica que preocupa as autoridades, pois a dependência desta substancia é de difícil gestão terapêutica.
A Coordenação Nacional da Estratégia do Medicamento e dos Produtos de Saúde, em colaboração com o Infarmed, outros treze departamentos do Ministério da Saúde e as Ordens dos Farmacêuticos, dos Médicos e dos Psicólogos, delinearam uma campanha de sensibilização junto dos profissionais de saúde e dos cidadãos em geral com o objetivo de alertar para os riscos associados ao consumo prolongado de benzodiazepinas. Cerca de 10% da população consome regularmente estes fármacos.
Mais informação: Ministério da Saúde| Ordem dos Farmacêuticos | Panfleto informativo Ministério da Saúde
As sensações de prazer que normalmente geram as drogas que produzem dependência, desastrosamente atraentes para indivíduos vulneráveis, ocorrem quando os níveis de dopamina na área de recompensa (ou prazer) do cérebro aumentam abruptamente. Este tipo de drogas interferem nos mecanismos naturais do organismo de controlar o fluxo de dopamina. Mais concretamente, as benzodiazepinas enfraquecem a ação de um grupo de neurónios denominados interneurónios, que se encontram na área tegmental ventral do cérebro (VTA). Esses interneurónios normalmente ajudam a prevenir os níveis excessivos de dopamina, regulando as taxas de disparo dos neurónios produtores de dopamina. Portanto, quando benzodiazepinas limitam a influência restritiva dos interneurónios, os neurônios produtores de dopamina liberam mais dopamina do que o normal.(6)
A dopamina é a substância química que medeia o prazer no cérebro. A sua produção ocorre em situações agradáveis e tem como objetivo estimular a busca de atividade prazerosas, importantes para a sobrevivência, com a alimentação ou o sexo. Algumas drogas como os opióides e as benzodiazepinas, apresentam a capacidade de estimular artificialmente a produção de dopamina no cérebro, dando origem a desequilíbrios no processo natural de recompensa/sobrevivência.
Alternativas naturais ás benzodiazepinas
Uma vez que não se espera que os fatores responsáveis pela ansiedade e insónia diminuam, é fundamental para a qualidade de vida do paciente encontrar alternativas ansiolíticas com menor potencial para induzir reações adversas. Neste sentido, tem se verificado um grande interesse por parte da comunidade científica no estudo de plantas medicinais (7). Desde a antiguidade, algumas plantas têm sido utilizadas para o tratamento da insónia e da ansiedade e, atualmente, o uso de seus extratos tem ganhado cada vez mais aceitação pela classe médica (7). Não obstante, para a maioria das plantas medicinais faltam dados químicos e farmacológicos e, em muitos casos, os seus princípios ativos ainda não foram quimicamente identificados e estudados. Se espera que com o avanço dos estudos científicos na área da fitoquímica e fitomedicina, passemos a contar com um número maior de recursos naturais para ajudar no tratamento deste tipo de distúrbios.
Entre as varias plantas medicinais conhecidas por suas propriedades ansiolíticas, sedativas e de relaxante muscular, podemos destacar a kava-kava (Piper methysticum), a passiflora (Passiflora incarnata), a grifónia (Griffonia simpliciflia), a valeriana (Valeriana officinalis), a camomila (Matricaria recutita) e a arnica (Galphimia glauca). Estas plantas foram amplamente estudadas e seus princípios ativos mais importantes identificados. Entre os exemplos citados, a kava-kava deixou de estar autorizada como ingrediente em suplementos alimentares na Europa a partir de 2002 devido à suspeita de hepatotoxidade (8).
O exemplo de 4Sleep: 4 ingredientes poderosos para ajudar a dormir melhor
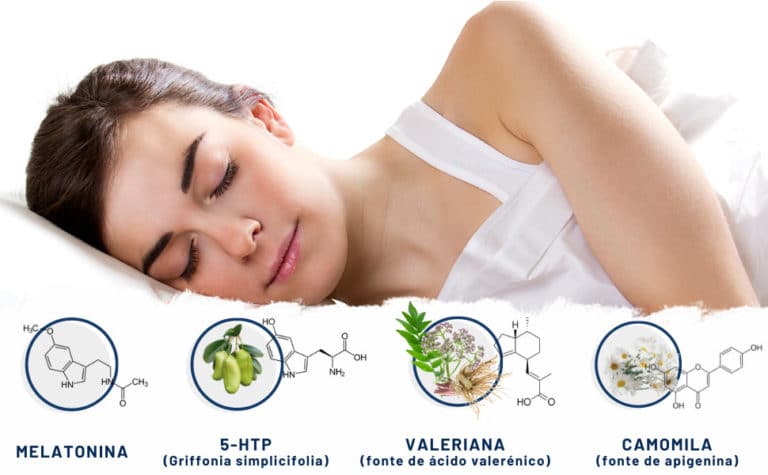
Conscientes da necessidade de oferecer alternativas seguras para ajudar as pessoas que sofrem de insónia e têm dificuldade em conciliar o sono, Nutribiolite desenvolveu 4Sleep. Trata-se de um suplemento alimentar de venda livre que combina melatonina e os extratos concentrados de grifónia, valeriana e camomila. Cada um destes ingredientes individualmente demonstraram, em distintos artigos científicos publicados em revistas da especialidade, propriedades ansiolíticas importantes que ajudam a promover os processos biológicos associados ao relaxamento e a conciliação do sono. A combinação destes ingredientes tem como objetivo a obtenção de um efeito aditivo que proporcione um efeito de indução do sono progressivo e duradouro. Nos seguintes capítulos, fazemos um pequeno resumo das propriedades de cada um desses ingredientes de 4Sleep.

Clique na imagem para ampliar
Melatonina
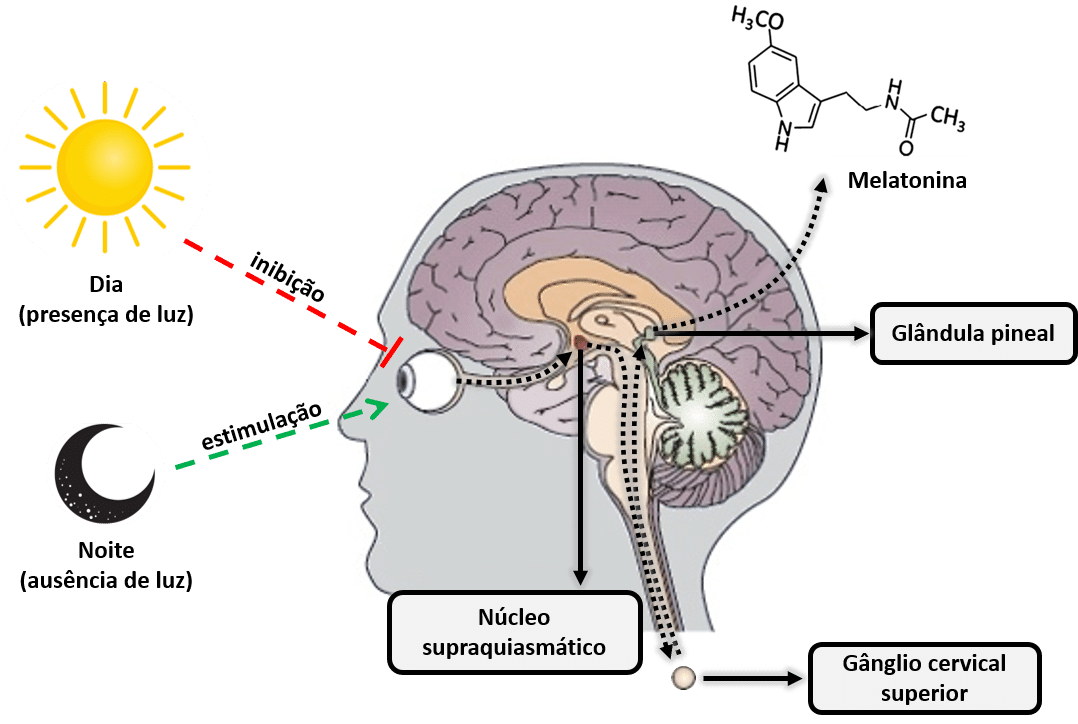
A melatonina, ou N-acetil-5-metoxitriptamina, é uma hormona produzida principalmente pela glândula pineal (localizada na parte posterior do cérebro) a partir do aminoácido triptofano e derivada de uma outro hormona, a serotonina. A melatonina é extremamente importe na regulação do relógio biológico do corpo (ciclo circadiano ou ciclo de sono-vigília) e do metabolismo energético. Esta hormona é produzida quando a retina deteta a ausência de luz, de tal maneira que a sua biossíntese diária obedece precisamente uma produção rítmica circadiana sincronizada ao ciclo de iluminação ambiental característico do dia e da noite. Essa produção rítmica diária é tal que, em qualquer espécie considerada, o pico de produção se dá durante a noite. Outra característica importante do sistema funcional neural que regula a síntese de melatonina é que luz presente no meio ambiente à noite pode bloquear completamente (dependendo de sua intensidade e comprimento de onda, principalmente a luz azul de 480 nm), a síntese de melatonina pineal (9). Por este motivo é importante para a conciliação do sono a ausência total de luz artificial. Hábitos como o de utilizar o smartphone ou outro dispositivo eletrónico com ecrãs luminescentes, dificultam a criação dos mecanismos biológicos que desencadeiam a produção natural de melatonina.
(clique na imagem para ampliar)
Figura 2: Esquema de processos que inibem e estimulam a produção pineal de melatonina.
A quantidade de melatonina não é constante ao longo da vida. A sua produção inicia-se em bebés depois dos 3-4 meses de idade e os seus níveis aumentam ao longo da infância até atingir um valor máximo entre os 8-10 anos. A partir daí, a sua produção começa a diminuir, um processo que ocorrerá até o final da vida. Quando atingimos os 40-45 anos de idade ocorre uma diminuição brusca da produção de melatonina. Em indivíduos maiores de 70 anos, os níveis de melatonina já são inferiores a 10% dos valores tipicamente observados em crianças entre 8-10 anos de idade (10).
Segundo vários estudos científicos, a suplementação oral com melatonina é benéfica e contribui para reduzir o tempo necessário para conciliar o sono (11, 12), ajuda a reduzir os distúrbios do sono relacionados com o jet lag em trabalhadores noturnos (13), nos transtornos de déficit de atenção e hiperatividade (TDAH) (14), na alterações do ritmo circadiano em pessoas cegas (15) e em problemas de sono decorrentes da menopausa (16, 17). A melatonina atravessa com facilidade a barreira hematoencefálica, acumulando-se no sistema nervoso central em níveis substancialmente mais elevados do que os existentes no sangue (18). Neste sentido a suplementação com melatonina (exógena) é bastante eficiente, especialmente em indivíduos com baixos valores de melatonina endógena (19). Devido a fácil acumulação de melatonina no cérebro, não é recomendada a toma de quantidades elevadas diárias desta substância, principalmente em indivíduos mais velhos, devido à diminuição do funcionamento hepático e renal, bem como à mudanças na composição corporal (gordura e retenção de água) que alteram as propriedades farmacocinéticas da melatonina e aumentam o risco de efeitos adversos como a sonolência do dia seguinte (20, 21).
Tendo em conta a procura de melhor relação benefício/risco para os consumidores europeus, em 2001, na sequência de um pedido da comissão europeia, o painel de produtos dietéticos, nutrição e alergias da Autoridade Europeia para a Segurança dos Alimentos (EFSA) elaborou um parecer científico sobre as propriedades benéficas da melatonina para o sono e sobre que quantidades seriam as ideais para a obtenção destes benefícios. O painel levou em consideração vários estudos de meta-análise controlado por placebo em pessoas sem problemas de sono, em indivíduos com distúrbios primários de sono e em indivíduos com insónia (26). Segundo essa revisão científica, a EFSA concluiu que a quantidade de 1 mg de melatonina consumida antes de deitar, efetivamente ajuda na conciliação do sono (22–25). Em consequência disso, vários países europeus estabeleceram limites a dose máxima diária autorizada de melatonina em suplementos alimentares, por exemplo: Espanha (1,9 mg), Portugal (1,9 mg), Grécia (3,0 mg), França (2,0 mg), Holanda (0,3 mg) e Itália (1 mg). A partir destes valores, a melatonina é considerada um medicamento e a sua venda passa a estar controlada por prescrição médica e apenas indicada para pessoas clinicamente diagnosticadas com deficit de melatonina endógena.
Tendo como base o parecer científico da EFSA e cumprindo com os regulamentos de todos os países europeus nos quais Nutribiolite comercializa os seus produtos, 4Sleep incorpora exatamente 1 mg de melatonina na sua fórmula. Com efeito, uma quantidade superior (até 1,9 mg) deste principio ativo é desnecessária, segundo vários estudos de meta-análise (22–25). Ademais, o processo de conciliação do sono também depende de outros mecanismos de relaxação desencadeados no sistema nervoso central, e por este motivo, 4Sleep se baseia na combinação de melatonina com outros três princípios ativos obtidos das plantas medicinais grifónia, valeriana e camomila que descrevemos a seguir.
A grifónia: fonte de 5-HTP e precursor de serotonina e melatonina
Outro princípio ativo presente na fórmula de 4Sleep é o L-5-hidroxitriptofano, também conhecido como 5-HTP, um aminoácido precursor e intermediário na biossíntese dos neurotransmissores serotonina e melatonina (figura 3). A existência do 5-HTP na natureza não se limita apenas aos mamíferos, como os seres humanos, mas também é produzido por plantas, cogumelos e micróbios. A semente da grifónia (Griffonia simplicifolia (DC.) Baill.) é uma das fontes vegetais mais ricas em 5-HTP, o que fez com que se desenvolvessem métodos bastante robustos tanto para a produção de extratos concentrados como para a caracterização analítica dos mesmos. Consequentemente, tanto os laboratórios farmacêuticos como os laboratórios fabricantes de suplementos alimentares têm atualmente ao seu dispor extratos padronizados de grifónia em termos de 5-HTP de excelente qualidade (27). Em 4Sleep se utiliza um extrato de grifonia altamente concentrado em 5-HTP (> 98%), determinado por cromatografia líquida de alta resolução (HPLC).
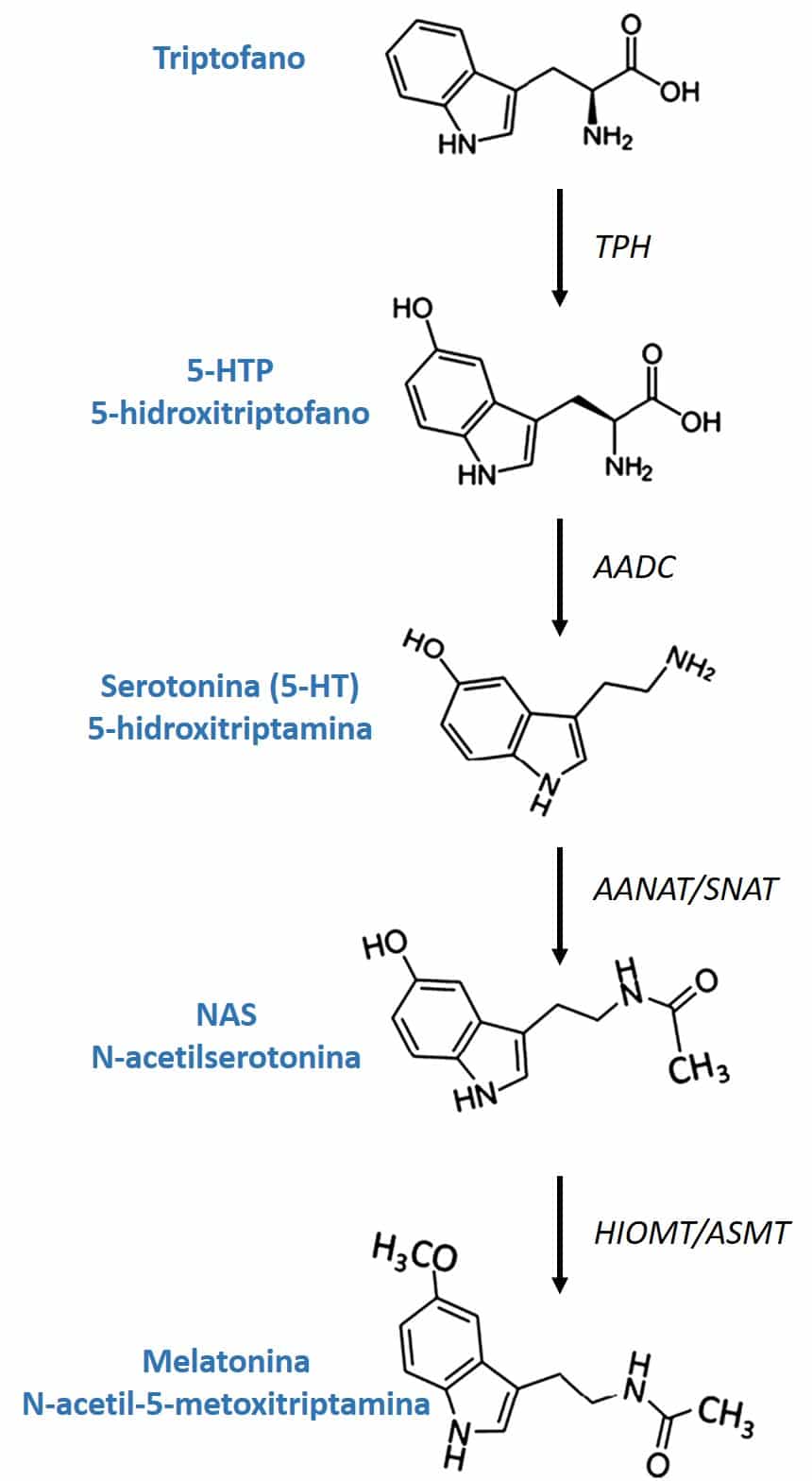
Figura 3: Biossíntese da melatonina
A conversão do 5-HTP em serotonina no organismo é levada a cabo através da enzima AADC (L-aminoácido descarboxilase aromática). A sua conversão em melatonina envolve duas enzimas que são produzidas pela glândula pineal após ser induzida pela retina devido a ausência de luz: a enzima SNAT (serotonina-N-acetiltransferase) converte a serotonina em N-acetilserotonina e a enzima (HIOMT) hidroxiindol-O- metiltrasferase transfere um grupo metilo da S-adenosilmetionina para o 5-hidroxil da N-acetilserotonina, dando origem a melatonina.
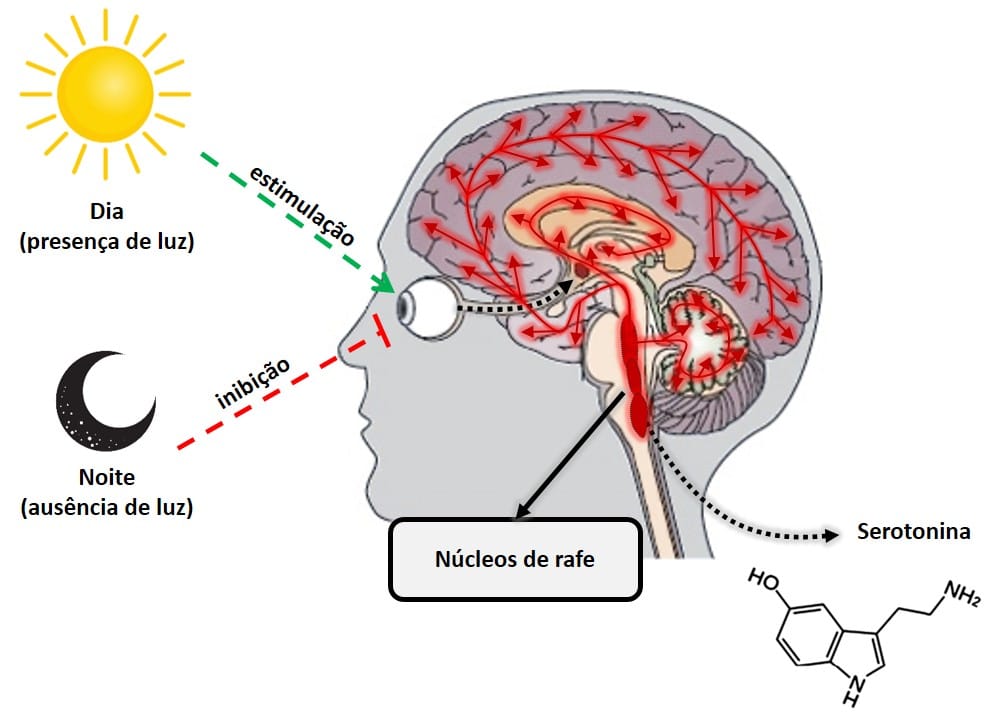
A serotonina e a melatonina são quase literalmente dia e noite em termos hormonais. Estas duas hormonas realizam trabalhos opostos, mas em completa harmonia, para manter o organismo em equilíbrio. A serotonina, conhecida como a “hormona da felicidade”, é um neurotransmissor que desempenha um papel fundamental na regulação de quase todas as funções do sistema nervoso central, como o estado de animo, ansiedade, stress, fome, cognição e o comportamento sexual. Ao contrário da melatonina, a serotonina tem o seu pico de produção durante o dia, quando a retina deteta a presença de luz. A sua produção se dá principalmente numa zona do cérebro denominada núcleos da rafe.
(clique na imagem para ampliar)
Figura 4: Produção de serotonina pelos núcleos da rafe
A função do 5-HTP em 4Sleep, é proporcionar uma fonte secundaria de melatonina, que será produzida paulatinamente via serotonina durante a noite. Com efeito, vários estudos científicos verificaram que a administração de 5-HTP ademais de aumentar os níveis de serotonina, também produziram um aumento nos níveis de melatonina (28).
Apesar de atuar como fonte de 5-HTP no organismo, a suplementação com L-triptofano em vez de 5-HTP, com o objetivo de aumentar os níveis de serotonina e melatonina no organismo, apresenta desvantagens. Isso se deve ao facto do organismo utilizar o L-triptofano também para outras finalidades, como a formação de proteínas e a produção de niacina a partir da quinurenina. Além disso, o 5-HTP atravessa a barreira hematoencefálica com muito mais facilidade, convertendo-se em serotonina mais rapidamente (apresenta maior biodisponibilidade) (29)
Camomila
Uma característica das plantas medicinais é o facto de estarem quase sempre constituídas por uma mistura variada de princípios ativos, o que faz com que uma mesma espécie vegetal apresente varias propriedades medicinais distintas. A camomila ou Matricaria chamomilla L. (também conhecida por Chamomilla recutita ou Matricaria recutita) (figura 5) é um claro exemplo disso. Esta planta herbácea nativa da Europa e da Ásia Ocidental tem varias utilizações medicinais, das quais podemos destacar a sua utilização como anti-inflamatório, antibacteriano, digestivo, ansiolítico, antiespasmódicos e anticonvulsivante (30, 31). A parte da planta mais utilizada são as suas flores, constituídas por vários compostos fenólicos, principalmente os flavonóides apigenina, quercetina, patuletina, luteolina e seus glicosídeos (31). No que diz respeito às propriedades ansiolíticas da camomila, estas são devidas à presença de apigenina, um polifenol flavonóide muito abundante nas flores desta planta e que constitui 68% do seu conteúdo total de flavonóides (32).

Figura 5: A flor de camomila .
As propriedades ansiolíticas da camomila foram estudadas pela primeira vez em 1982 pelo grupo do Dr.Roberto DellaLoggia da Faculdade de Farmácia da Universidade de Trieste (33). Utilizando um modelo animal com ratos, se observou que a administração de uma infusão de camomila foi capaz de exercer uma ação depressiva sobre o sistema nervoso central dos animais, através da redução do ritmo basar e da indução do sono. Também observou que a intensidade destes efeitos era dependente da concentração da infusão utilizada, o que também corroborava que os efeitos ansiolíticos observados vinham da administração da camomila. Depois deste estudo, muitos outros se seguiram, mas agora com o intuito de identificar o componente da planta responsável por esta propriedade. Em 1995 Viola e colaboradores demonstraram que a flor de camomila contém várias moléculas capazes de se ligar competitivamente aos mesmos sítios de ligação das benzodiazepinas, das quais se destacou a apigenina, por apresentar uma clara atividade ansiolítica em ratos (34). Em outras palavras, este estudo sugeria que a apigenina poderia apresentar propriedades similares as benzodiazepinas, ao se ligar aos mesmos sítios de união utilizados pelas benzodiazepinas nos recetores GABA-A. Outros estudos sugerem que os efeitos da apigenina nos recetores GABA-A são mais complexos e que outros recetores podem estar envolvidos nos seus efeitos ansiolíticos (35–37). A apigenina, muito provavelmente, atua como um modulador de segunda ordem dos recetores GABA-A, neste caso, aumentando o efeito de um modulador de primeira ordem. As atividades sedativas e ansiolíticas da apigenina observadas em ratos (34,35) podem ser interpretadas com base na apigenina, potencializando a ação de agentes endógenos semelhantes as benzodiazepinas nos neurónios (38, 39).
Devido propriedades medicinais benéficas das flores de camomila, a Autoridade Europeia para a Segurança dos Alimentos (EFSA) se encontra a avaliar varias declarações de saúde relacionadas com a camomila como a sua contribuição para a relaxação (EFSA-Q-2010-00538) e para a manutenção de um sono saudável (EFSA-Q-2010-00586).
Em 4Sleep, cada cápsula (o que corresponde a dose diária recomendada), contém 110 mg de um extrato concentrado (4:1) de camomila, o que equivale ao consumo de 440 mg de flores de camomila secas por dose. Esta é uma forma cómoda e efetiva de obter os benefícios da camomila.
Valeriana
A valeriana (Valeriana officinalis L.), uma planta perene nativa da América do Norte, Ásia e Europa, também é outra espécie tradicionalmente utilizada por suas propriedades ansiolíticas (40) (figura 6). Com efeito, é uma das espécies mais utilizadas e uma das quais mais estudos foram realizados para verificar seus efeitos no tratamento da insónia e outros sintomas associados ao nervosismo. A parte da planta mais utilizada é a sua raiz, constituída por vários sesquiterpenóides e iridóides. Os compostos ativos mais importantes da raiz da valeriana são os valepotriatos (um iridóide) e o ácido valerénico (um sesquiterpenóide). Originalmente, pensava-se que apenas os valepotriatos, eram responsáveis pelos efeitos sedativos da valeriana, no entanto, os extratos puramente aquosos de valeriana, como aqueles obtidas nas infusões (chás), também demonstraram apresentar efeito sedativo (40, 41). Como os valepotriatos não são solúveis em água, concluiu-se que o ácido valerénico presente na raiz da valeriana também apresentasse propriedades ansiolíticas e era o componente químico principal responsável pelo efeito observado em ensaios clínicos com humanos. Além dos valepotriatos e do acido valerénico, em 2002 se isola pela primeira vez o flavonóide 6-metilapigenina e se demonstra que esta molécula é capaz de se unir aos recetores GABA-A produzindo um efeito ansiolítico similar as benzodiazepinas (42). Nos anos seguintes se isolaram os glicosídeos hesperidina (43) e linarina (44), que também são capazes de se unir aos recetores GABA-A, apresentando propriedades sedativas e hipnóticas. Além disso, o efeito da hesperidina foi sinergicamente potencializado pela 6-metilapigenina e o da linarina pelo ácido valerénico presente na composição de valeriana.

Figura 6: A raiz da valeriana.
Os valepotriatos mostraram citotoxicidade em estudos in vitro, embora o mesmo não tenha sido demonstrado em estudos in vivo. Devido a alta instabilidade química dos valepotriatos, estes são dificilmente encontrados em preparações fitofarmacêuticas comerciais como os suplementos alimentares e ademais, apresentam baixa absorção (45). De qualquer modo, os extratos de valeriana utilizados em suplementos alimentares são obtidos através de uma mistura controlada de água/bioetanol de maneira a não extrair os valepotriatos.
O extrato de valeriana de 4Sleep é certificado por laboratórios credenciados e não apresenta valepotriatos. A exigência deste certificado é um dos critérios necessários para a sua comercialização na Europa.
De todos os componentes da valeriana, o que exerce o efeito ansiolítico mais importante é o ácido valerénico (46). Ademais, de todas as substancias identificadas na valeriana detentoras desta propriedade, o ácido valerénico é o que se apresenta em maior quantidade nesta planta. Esta substancia também apresenta capacidade de modular os recetores de GABA-A, produzindo um efeito supressor da atividade neuronal. Neste caso, em vez de se ligar à subunidade gama como ocorre no caso das benzodiazepinas, o ácido valerénico parece ligar-se à subunidade beta no recetor GABA-A (47–50).
São ainda poucos os estudos clínicos controlados realizados com valeriana, no entanto, os resultados disponíveis sugerem que seu uso facilita a reestruturação da arquitetura do sono após várias semanas de tratamento e, assim, melhora sua qualidade. Também há indícios de que este desempenha um papel importante na redução do stress da ansiedade nos pacientes em que essa condição interfere no início e na manutenção do sono, bem como no tratamento adjuvante na suspensão do uso prolongado de benzodiazepínicos (51).
Se encontram sob avaliação pela EFSA várias declarações de saúde relativamente a esta planta, como por exemplo: ajuda a iniciar o sono e a manter a sua qualidade (EFSA-Q-2008-3413, EFSA-Q-2008-4771) e fornece suporte para o bem-estar mental (EFSA-Q-2008-4932).
Em 4Sleep, cada cápsula (o que corresponde a dose diária recomendada), contém 110 mg de extrato de raiz de valeriana concentrado (3:1), que é equivalente a 330 mg de raiz de valeriana seca por cápsula.
1. Chaput, J.-P., et al. (2018). “Sleeping hours: what is the ideal number and how does age impact this?” Nature and Science of Sleep 10: 421-430.
2. Hood, S. D., et al. (2014). “Benzodiazepine dependence and its treatment with low dose flumazenil.” British Journal of Clinical Pharmacology 77(2): 285-294.
3. Ngo, D.-H.; Vo, T. S. Molecules (Basel, Switzerland) 2019, 24, 2678.
4. C. Furtado and I. Teixeira, Acta Médica Portuguesa, 2006, 19, 239-246.
5. Vaz, S. I. A. (2020). Avaliação da Utilização versus Uso Indevido de benzodiazepinas. Ciências da Saúde. Covilhã, Universidade da Beira Interior.
6. Tan, K. R., et al. (2010). “Neural bases for addictive properties of benzodiazepines.” Nature 463(7282): 769-774.
7. Carlini, E. A. (2003). “Plants and the central nervous system.” Pharmacology Biochemistry and Behavior 75(3): 501-512.
8. Sarris, J., et al. (2011). “Re-introduction of Kava (Piper methysticum) to the EU: Is There a Way Forward?” Planta Med 77(02): 107-110.
9. Arendt, J. Reviews of reproduction 1998, 3, 13.
10. Karasek, M. Experimental Gerontology 2004, 39, 1723.
11. Costello, R. B., et al. (2014). “The effectiveness of melatonin for promoting healthy sleep: a rapid evidence assessment of the literature.” Nutrition Journal 13(1): 106.
12. Ferracioli-Oda, E., et al. (2013). “Meta-analysis: melatonin for the treatment of primary sleep disorders.” PLOS ONE 8(5): e63773.
13. Hunter, C. M.; Figueiro, M. G. Biological research for nursing 2017, 19, 365.
14. Rzepka-Migut, B.; Paprocka, J. Brain sciences 2020, 10.
15. Hartley, S.; Dauvilliers, Y.; Quera-Salva, M.-A. Current Neurology and Neuroscience Reports 2018, 18, 65.
16. Cagnacci, A. Climacteric 2017, 20, 183.
17. Chojnacki, C.; Kaczka, A.; Gasiorowska, A.; Fichna, J.; Chojnacki, J.; Brzozowski, T. Journal of physiology and pharmacology : an official journal of the Polish Physiological Society 2018, 69.
18. Tan, D.-X. (2010). “Melatonin and brain.” Current neuropharmacology 8(3): 161-161.
19. Zisapel, N. (2018). “New perspectives on the role of melatonin in human sleep, circadian rhythms and their regulation.” British Journal of Pharmacology 175(16): 3190-3199.
20. Andersen, L. P., et al. (2016). “The Safety of Melatonin in Humans.” Clin Drug Investig 36(3): 169-175.
21. Gooneratne, N. S., et al. (2012). “Melatonin pharmacokinetics following two different oral surge-sustained release doses in older adults.” Journal of pineal research 52(4): 437-445.
22. Brzezinski, A., et al. (2005). “Effects of exogenous melatonin on sleep: a meta-analysis.” Sleep Medicine Reviews 9(1): 41-50.
23. Buscemi N, et al. (2004). “Melatonin for Treatment of Sleep Disorders: Summary.” In: AHRQ Evidence Report Summaries. Rockville (MD): Agency for Healthcare Research and Quality (US); 1998-2005. 108.
24. Buscemi, N., et al. (2005). “The efficacy and safety of exogenous melatonin for primary sleep disorders. A meta-analysis.” J Gen Intern Med 20(12): 1151-1158.
25. Buscemi, N., et al. (2006). “Efficacy and safety of exogenous melatonin for secondary sleep disorders and sleep disorders accompanying sleep restriction: meta-analysis.” BMJ (Clinical research ed.) 332(7538): 385-393.
26. Scientific Opinion on the substantiation of a health claim related to melatonin and reduction of sleep onset latency (ID 1698, 1780, 4080) pursuant to Article 13(1) of Regulation (EC) No 1924/2006 – 2011 – EFSA Journal.
27. Maffei, M. E. (2020) 5-Hydroxytryptophan (5-HTP): Natural Occurrence, Analysis, Biosynthesis, Biotechnology, Physiology and Toxicology. International journal of molecular sciences 22.
28. Birdsall, T. C. (1998). “5-Hydroxytryptophan: a clinically-effective serotonin precursor.” Altern Med Rev 3(4): 271-280.
29. Zagajewski, J., et al. (2012). “Conversion L-tryptophan to melatonin in the gastrointestinal tract: the new high performance liquid chromatography method enabling simultaneous determination of six metabolites of L-tryptophan by native fluorescence and UV-VIS detection.” J Physiol Pharmacol 63(6): 613-621.
30. Srivastava, J. K.; Shankar, E.; Gupta, S. Mol Med Rep 2010, 3, 895.
31. McKay, D. L. and J. B. Blumberg (2006). “A Review of the bioactivity and potential health benefits of chamomile tea (Matricaria recutita L.).” Phytotherapy Research 20(7): 519-530.
32. Venigalla, M., et al. (2015). “Curcumin and Apigenin – novel and promising therapeutics against chronic neuroinflammation in Alzheimer’s disease.” Neural regeneration research 10(8): 1181-1185.
33. Loggia, R. D., et al. (1982). “Depressive effects of Chamomilla recutita (L.) Rausch, tubular flowers, on central nervous system in mice.” Pharmacological Research Communications 14(2): 153-162.
34. Viola, H., et al. (1995). “Apigenin, a Component of Matricaria recutita Flowers, is a Central Benzodiazepine Receptors-Ligand with Anxiolytic Effects.” Planta Med 61(03): 213-216.
35. Avallone, R., et al. (2000). “Pharmacological profile of apigenin, a flavonoid isolated from Matricaria chamomilla.” Biochem Pharmacol 59(11): 1387-1394.
36. Salgueiro, J. B., et al. (1997). “Anxiolytic Natural and Synthetic Flavonoid Ligands of the Central Benzodiazepine Receptor Have No Effect on Memory Tasks in Rats.” Pharmacology Biochemistry and Behavior 58(4): 887-891.
37. Wasowski, C. and M. Marder (2012). “Flavonoids as GABAA receptor ligands: the whole story?” J Exp Pharmacol 4: 9-24.
38. Hanrahan, J. R., et al. (2011). “Flavonoid modulation of GABA(A) receptors.” British Journal of Pharmacology 163(2): 234-245.
39. Royal Society of New South, W. (2003). Dietary Chemicals and Brain Function. Journal and proceedings of the Royal Society of New South Wales. Sydney :, C. Potter, Acting. Govt. Printer. 135.
40. Houghton, P. J. (1999). “The scientific basis for the reputed activity of Valerian.” J Pharm Pharmacol 51(5): 505-512.
41. Andreatini, R., et al. (2002). “Effect of valepotriates (valerian extract) in generalized anxiety disorder: a randomized placebo-controlled pilot study.” Phytother Res 16(7): 650-654
42. Wasowski, C., et al. (2002). “Isolation and identification of 6-methylapigenin, a competitive ligand for the brain GABA(A) receptors, from Valeriana wallichii.” Planta Med 68(10): 934-936
43. Marder, M., et al. (2003). “6-Methylapigenin and hesperidin: new valeriana flavonoids with activity on the CNS.” Pharmacology Biochemistry and Behavior 75(3): 537-545
44. Fernández, S., et al. (2004). “Sedative and sleep-enhancing properties of linarin, a flavonoid-isolated from Valeriana officinalis.” Pharmacology Biochemistry and Behavior 77(2): 399-404.
45. Villar Del Fresno, Á. M. and M. E. Carretero Accame (2001). “Valeriana officinalis. Fitoquímica, farmacología y terapéutica.” Farmacia Profesional 15(9): 98-107.
46. Benke, D., et al. (2009). “GABA A receptors as in vivo substrate for the anxiolytic action of valerenic acid, a major constituent of valerian root extracts.” Neuropharmacology 56(1): 174-181.
47. Khom, S., et al. (2007). “Valerenic acid potentiates and inhibits GABAA receptors: Molecular mechanism and subunit specificity.” Neuropharmacology 53(1): 178-187.
48. Becker, A., et al. (2014). “The anxiolytic effects of a Valerian extract is based on valerenic acid.” BMC Complement Altern Med 14: 267-267.
49. Trauner, G., et al. (2008). “Modulation of GABAA receptors by valerian extracts is related to the content of valerenic acid.” Planta Med 74(1): 19-24.
50. Das, G., et al. (2021). “Plant Species of Sub-Family Valerianaceae-A Review on Its Effect on the Central Nervous System.” Plants (Basel) 10(5).
51. Shinjyo, N., et al. (2020). “Valerian Root in Treating Sleep Problems and Associated Disorders—A Systematic Review and Meta-Analysis.” Journal of Evidence-Based Integrative Medicine 25: 1-31
Inscreva-se na nossa newsletter e ganhe 5% de desconto no seu primeiro pedido.
Esta oferta pode ser combinada com todas as outras ofertas do site.
¡Gracias por unirte a nosotros!
Le hemos enviado el código de descuento a su correo electrónico.
Estamos também em: